
Wetenschap
Wat omvatten metalen?
Gemeenschappelijke kenmerken:
* Goede geleiders van warmte en elektriciteit: Dit komt door het vrije verkeer van elektronen in hun structuur.
* kneedbaar en ductiel: Ze kunnen worden gehamerd in vellen (kneedbaarheid) en worden getrokken in draden (ductiliteit).
* glanzend (glanzend): Ze reflecteren het licht goed en geven hen een karakteristieke glans.
* vast bij kamertemperatuur: (Behalve voor kwik, wat een vloeistof is)
* Hoge dichtheid: Ze zijn over het algemeen dicht in vergelijking met niet-metalen.
* Hoog smelten- en kookpunten: Dit is opnieuw gerelateerd aan de sterke metalen binding.
categorieën van metalen:
1. Alkali -metalen (groep 1): Lithium (Li), Natrium (NA), Kalium (K), Rubidium (RB), Cesium (CS), Francium (FR)
2. Alkalische aardmetalen (groep 2): Beryllium (be), magnesium (mg), calcium (ca), strontium (sr), barium (ba), radium (ra)
3. overgangsmetalen: Deze grote groep omvat de meeste bekende metalen zoals ijzer (Fe), koper (Cu), goud (AU), zilver (AG), nikkel (NI) en nog veel meer.
4. Lanthanides: Een reeks van 15 elementen met vergelijkbare eigenschappen, gevonden in de onderste rij van de periodiek systeem.
5. Actiniden: Nog een serie van 15 radioactieve elementen, ook gevonden in de onderste rij.
6. Andere metalen: Deze categorie omvat elementen zoals aluminium (AL), TIN (SN), lead (PB) en meer.
belangrijke opmerkingen:
* Niet alle metalen zijn gelijk gemaakt. Sommige zijn zeer reactief (zoals alkali -metalen), terwijl anderen erg niet -reactief zijn (zoals goud).
* De eigenschappen van metalen kunnen worden beïnvloed door hun atoomstructuur en opstelling.
* Legeringen zijn mengsels van metalen (of metalen met andere elementen) die unieke eigenschappen creëren.
Vergeet niet dat dit slechts een basisoverzicht is van de uitgestrekte en complexe wereld van metalen. Er is veel meer te leren over hun eigenschappen, toepassingen en belang in ons dagelijks leven.
 Waarom zijn de wetlands van Brazilië in vlammen opgegaan?
Waarom zijn de wetlands van Brazilië in vlammen opgegaan? Een invasief 'gigantisch' reptiel schuilt onder de veranda van Georgia, zeggen ambtenaren:dit is waarom het gevaarlijk is
Een invasief 'gigantisch' reptiel schuilt onder de veranda van Georgia, zeggen ambtenaren:dit is waarom het gevaarlijk is  Huis van eilandbewoners, Netten die plastic rietjes achterlaten
Huis van eilandbewoners, Netten die plastic rietjes achterlaten Waarom denk je dat de Britten een fysiek kenmerk zouden gebruiken om grenzen te stellen?
Waarom denk je dat de Britten een fysiek kenmerk zouden gebruiken om grenzen te stellen?  Experts wegen in op orkaan Ida en dodelijke plotselinge overstromingen in New York City
Experts wegen in op orkaan Ida en dodelijke plotselinge overstromingen in New York City
Hoofdlijnen
- Wat wordt pH beïnvloed?
- Kunnen tweelingen elkaar voelen?
- Wat is de wetenschappelijke naam voor een shag met blauwe ogen?
- Welke factor is niet beschikbaar geweest voor wetenschappers en niet gebleven om een levende cel te kunnen produceren?
- Wat was er eerst:het hoofd of de hersenen?
- Wat is het belangrijkste orgaan in het reproductieve systeem?
- Welk vermelde molecuul zal het meest waarschijnlijk osmose in het lichaam veroorzaken?
- Hoe puur is jouw patchouli?
- Wat is het belang van microscoop in zolaogie?
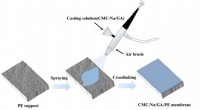
- Pervaporatiemembranen zijn veelbelovend voor de terugwinning van alkalisch afvalwater
- Oog hebben voor kleuren:bedrukbare lichtsensoren

- Onderzoekers maken een magneet gemaakt van één molecuul
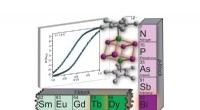
- Onderzoekers ontwikkelen nieuwe moleculaire ferro-elektrische metamaterialen

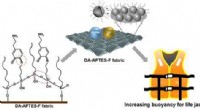
- Zwevend in de zomer met meer drijfvermogen, vloeistofdichte reddingsvesten en zwemkleding
 Wat is de eenheid van spanningsergie?
Wat is de eenheid van spanningsergie?  Menselijke spiercellen liften mee terwijl SpaceX een bevoorradingsmissie naar het ruimtestation lanceert
Menselijke spiercellen liften mee terwijl SpaceX een bevoorradingsmissie naar het ruimtestation lanceert Studie opent een nieuwe weg naar onzichtbaarheid zonder gebruik van metamaterialen
Studie opent een nieuwe weg naar onzichtbaarheid zonder gebruik van metamaterialen 17 Leg uit hoe kleur kan worden geclassificeerd als zowel een fysieke eigenschap als een indicatie van chemische verandering?
17 Leg uit hoe kleur kan worden geclassificeerd als zowel een fysieke eigenschap als een indicatie van chemische verandering?  Zonnewind vanuit het centrum van de aarde
Zonnewind vanuit het centrum van de aarde Kwantumwrijving vertraagt de waterstroom door koolstofnanobuisjes, waardoor een al lang bestaand vloeistofdynamica-mysterie wordt opgelost
Kwantumwrijving vertraagt de waterstroom door koolstofnanobuisjes, waardoor een al lang bestaand vloeistofdynamica-mysterie wordt opgelost Hoe de determinatiecoëfficiënt te berekenen
Hoe de determinatiecoëfficiënt te berekenen NASA ziet kleine tropische cycloon Caleb vervagen
NASA ziet kleine tropische cycloon Caleb vervagen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

