
Wetenschap
Waarom is waterstof de zwakste chemische binding?
* Het type binding: Er zijn verschillende soorten chemische bindingen, zoals ionische, covalente en metalen bindingen.
* De betrokken atomen: De grootte, elektronegativiteit en het aantal elektronen in de atomen die deelnemen aan de binding beïnvloeden de sterkte ervan.
* De omliggende omgeving: Factoren zoals temperatuur en druk kunnen de bindingssterkte beïnvloeden.
Hoewel waterstofbindingen over het algemeen zwakker zijn dan covalente bindingen, zijn ze nog steeds belangrijk voor veel biologische processen.
Hier is een uitsplitsing van de reden waarom waterstofbindingen vaak worden beschouwd als zwakker:
* Ze komen voort uit elektrostatische interacties: Waterstofbindingen vormen zich als gevolg van de aantrekkingskracht tussen een gedeeltelijk positief waterstofatoom en een gedeeltelijk negatief atoom zoals zuurstof of stikstof. Deze elektrostatische aantrekkingskracht is zwakker dan het gedeelde elektronenpaar dat wordt gevonden in covalente bindingen.
* ze zijn relatief lang: De afstand tussen de waterstof en het elektronegatieve atoom is relatief groot in vergelijking met covalente bindingen. Dit verhoogt de afstand waarover de elektrostatische aantrekkingskracht werkt, waardoor deze zwakker wordt.
* ze kunnen gemakkelijk worden verbroken: Waterstofbindingen worden gemakkelijk verbroken door thermische energie, daarom worden ze vaak verstoord bij hogere temperaturen.
Het is belangrijk op te merken:
* Er zijn ook sterke waterstofbruggen. In sommige gevallen kunnen waterstofbruggen vrij sterk zijn, vooral wanneer meerdere waterstofbruggen aanwezig zijn.
* waterstofbindingen zijn cruciaal voor het leven. Ze spelen een cruciale rol bij het bij elkaar houden van de structuur van DNA, eiwitten en water.
Samenvattend: Hoewel waterstofbindingen over het algemeen zwakker zijn dan covalente bindingen, zijn ze nog steeds essentieel voor veel biologische en chemische processen. De sterkte van een binding hangt af van meerdere factoren, en het is niet nauwkeurig om te zeggen dat waterstof de zwakste binding in alle situaties is.
 Naar huis vliegen? De ijstijd heeft mogelijk de vogelmigratie afgeremd
Naar huis vliegen? De ijstijd heeft mogelijk de vogelmigratie afgeremd  Onderzoek toont aan hoe klimaatverandering de gezondheid bedreigt
Onderzoek toont aan hoe klimaatverandering de gezondheid bedreigt  Waarom is TI nodig voor mensen die niet van plan zijn om een carrière in de wetenschap te laten informeren over het milieu?
Waarom is TI nodig voor mensen die niet van plan zijn om een carrière in de wetenschap te laten informeren over het milieu?  Gesprekken over plasticvervuiling komen dichter bij het wereldprimeurpact
Gesprekken over plasticvervuiling komen dichter bij het wereldprimeurpact  Wat is een waarneembare eigenschap in de wetenschap?
Wat is een waarneembare eigenschap in de wetenschap?
Hoofdlijnen
- Wat is een georganiseerde reeks onderzoeksprocedures die door wetenschappers worden gebruikt?
- Studie:Hoe we omgaan met dieren werpt licht op de Amerikaanse sociale ongelijkheid
- Hoe drinkt bacteriën?
- Wat zijn de twee delen van de wetenschap?
- Onderscheid Rigor Mortis van een Cadaveric Spasm
- In welke staat groeit Waratah op natuurlijke wijze?
- Jongen of meisje? Het zit in de genen van de vader
- Welke cellen zijn gerangschikt in een normale patroonplant of dierlijke cel?
- Wat zijn de vier belangrijkste soorten metabolisme uitgevoerd door bodemorganismen?
- Elektrische kabel triggers lichtgewicht, ontdekking van brandwerende bekleding

- Samen beter:Mitochondriale fusie ondersteunt celdeling
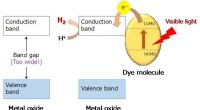
- Nieuw nanomateriaal ontwikkeld om watermoleculen te splitsen, verkrijgen van diwaterstof onder zonlicht
- Vrijstaande microwire-array maakt flexibel zonnevenster mogelijk

- Geavanceerde microscopie onthult ongebruikelijke DNA-structuur

 Wiskundige ontdekt methode om modellering van polymeergroei te vereenvoudigen
Wiskundige ontdekt methode om modellering van polymeergroei te vereenvoudigen Hoe planten hun groene pigment chlorofyl binden
Hoe planten hun groene pigment chlorofyl binden  Australië is van plan $ 417 miljoen uit te geven aan waterstof, Koolstofopname
Australië is van plan $ 417 miljoen uit te geven aan waterstof, Koolstofopname Jong, hippe boeren:kom naar een stad bij jou in de buurt
Jong, hippe boeren:kom naar een stad bij jou in de buurt Breidt de ruimte zich uit binnen clusters van sterrenstelsels?
Breidt de ruimte zich uit binnen clusters van sterrenstelsels?  Onderzoek onderzoekt waarom dochters in Chinese gezinnen met een voorkeur voor zonen er niet in slagen te breken met langdurige uitbuiting
Onderzoek onderzoekt waarom dochters in Chinese gezinnen met een voorkeur voor zonen er niet in slagen te breken met langdurige uitbuiting  Hoe grotbiologie werkt
Hoe grotbiologie werkt  Samsung-rivaal OnePlus introduceert goedkopere Android-telefoons voor 5G-videofans en gamers
Samsung-rivaal OnePlus introduceert goedkopere Android-telefoons voor 5G-videofans en gamers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

