
Wetenschap
Waarom maken lathanide en actinide geen deel uit van de periodiek systeem?
Dit is waarom ze zo worden geplaatst:
* Elektronenconfiguratie: Lanthaniden en actiniden worden gekenmerkt door het vullen van respectievelijk de 4F- en 5F -orbitalen. Deze orbitalen zijn innerlijke orbitalen en dragen niet aanzienlijk bij aan de chemische eigenschappen van deze elementen. Om het hoofdlichaam van de tafel te voorkomen, worden ze gescheiden en hieronder geplaatst.
* Soortgelijke chemische eigenschappen: Elementen binnen elke serie vertonen zeer vergelijkbare chemische eigenschappen als gevolg van de geleidelijke vulling van deze innerlijke orbitalen. Deze gelijkenis maakt het handig om ze samen te groeperen.
Dus samengevat:
* Lanthanides (atomaire nummers 57-71) en actiniden (atoomnummers 89-103) zijn zeker Een deel van het periodiek systeem.
* Ze worden onder het hoofdlichaam geplaatst vanwege hun elektronenconfiguratie en vergelijkbare chemische eigenschappen.
 Mobiele telefoon-app levert nauwkeurige regenvalinformatie aan het publiek
Mobiele telefoon-app levert nauwkeurige regenvalinformatie aan het publiek Supertyfoon Wutips 25 mijl breed oog gezien door NASA-NOAA-satelliet
Supertyfoon Wutips 25 mijl breed oog gezien door NASA-NOAA-satelliet Verzuring in de Noordelijke IJszee erger dan verwacht
Verzuring in de Noordelijke IJszee erger dan verwacht UITLEG:Eén weersysteem overstroomt St. Louis en Kentucky
UITLEG:Eén weersysteem overstroomt St. Louis en Kentucky Geplande productie van fossiele brandstoffen overspoelt klimaatdoelen van Parijs
Geplande productie van fossiele brandstoffen overspoelt klimaatdoelen van Parijs
Hoofdlijnen
- Op welke basis bindt adenine in RNA?
- Verrassing in de kangoeroe-stamboom - een buitenstaander is een naast familielid, ten slotte
- De zijkanten van de DNA -ladder zijn verzonnen afwisselend suikermoleculen en koolhydraatgroepen?
- Waarom rotten impatien stengels rotten en afbreken aan de basis wanneer bladeren blossums gezond lijken, er is geen bewijs van insectenactiviteit?
- Wat was er eerst:de kip of het ei?
- Waarom stijgen gist in warme of koude temperaturen?
- Wanneer ziektekiemen het lichaam binnengaan, wat zijn antilichamen geproduceerd door?
- Welk orgaansysteem maakt geen deel uit van actief transport en verdediging in het menselijk lichaam?
- Nieuwe aanwijzingen over hoe poortwachter voor de celkern werkt
- Nieuwe methode om voorlopers te produceren voor koolstofvezelverwerking met hoge sterkte

- Nieuw materiaal maakt de weg vrij voor op afstand bestuurbare medicatie en elektronische pillen

- Kooldioxide verwijderen uit uitlaatgassen van elektriciteitscentrales

- Nieuwe technologie zet zonlicht, water en koolstofdioxide om in acetaat en zuurstof voor hoogwaardige brandstoffen en chemicaliën
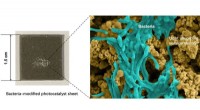
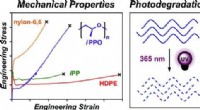
- Chemici maken sneller afbreekbaar plastic voor gebruik op zee
 Hoe ontstaat een plateau?
Hoe ontstaat een plateau?  Wat zijn de binnenste schilelektronen?
Wat zijn de binnenste schilelektronen?  Ford Tri-motor
Ford Tri-motor  Wat is het principe van thermische energie in behoud?
Wat is het principe van thermische energie in behoud?  Wat gebeurt er met het aantal protonen tijdens chemische binding?
Wat gebeurt er met het aantal protonen tijdens chemische binding?  Hoe de Amerikaanse mariniers werken
Hoe de Amerikaanse mariniers werken  Geef de formule van ionen aanwezig in natriumfosfaat?
Geef de formule van ionen aanwezig in natriumfosfaat?  Moeten we een film maken waar het publiek van geniet of moeten we een Oscar-nominatie binnenhalen? Onderzoek onthult de logica van studio's
Moeten we een film maken waar het publiek van geniet of moeten we een Oscar-nominatie binnenhalen? Onderzoek onthult de logica van studio's
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

