
Wetenschap
Kunnen stikstof- en chloorcovalente bindingen vormen?
* elektronegativiteit: Stikstof (N) en chloor (CL) zijn beide niet -metalen met relatief hoge elektronegativiteitswaarden. Dit betekent dat ze een sterke neiging hebben om elektronen aan te trekken.
* Elektronen delen: Wanneer stikstof- en chloorbinding elektronen delen om een stabiele octetconfiguratie in hun buitenste schalen te bereiken. Dit delen van elektronen is het bepalende kenmerk van een covalente binding.
Voorbeeld:
* stikstoftrichloride (NCL3): In dit molecuul vormt stikstof drie covalente bindingen met drie chlooratomen. Elk chlooratoom deelt één elektron met stikstof en stikstof deelt één elektron met elk chlooratoom.
Belangrijke opmerking: De binding tussen stikstof en chloor is polair covalent, wat betekent dat de elektronen niet gelijk worden gedeeld. Chloor is elektronegatiefer dan stikstof, dus de gedeelde elektronen worden dichter bij de chlooratomen getrokken. Dit resulteert in een gedeeltelijke negatieve lading op de chlooratomen en een gedeeltelijke positieve lading op het stikstofatoom.
 Welke plantenaanpassingen heeft de neritische zone?
Welke plantenaanpassingen heeft de neritische zone?  Studie:Hoe een grote kattengod mensen helpt de ruimte te delen met luipaarden in India
Studie:Hoe een grote kattengod mensen helpt de ruimte te delen met luipaarden in India  Het meten van methaan uit kolen en gas in Pennsylvania informatief
Het meten van methaan uit kolen en gas in Pennsylvania informatief Koeien dagelijks een paar ons zeewier voeren zou hun bijdrage aan klimaatverandering sterk kunnen verminderen
Koeien dagelijks een paar ons zeewier voeren zou hun bijdrage aan klimaatverandering sterk kunnen verminderen Hoe Australische supercomputers de cijfers hebben gekraakt om onze bosbranden en pandemische reactie te begeleiden
Hoe Australische supercomputers de cijfers hebben gekraakt om onze bosbranden en pandemische reactie te begeleiden
Hoofdlijnen
- Welk deel van een kokosplant eten mensen?
- Is regeneratieve landbouw een eco-wake-up call?
- De temperatuur van het zeeoppervlak in de Indische Oceaan blijkt een nauwkeurige voorspeller van dengue-uitbraken
- Twilight-truc:er is een nieuw type cel gevonden in het oog van een diepzeevis
- Het DNA van een menselijke cel kan worden gesneden en herschikt met behulp van?
- Genen bieden hoop voor het voortbestaan van Arabië's laatste grote kat
- Hoe weet het lichaam hoe hij mRNA moet produceren?
- Moderne genetische sequencing-instrumenten geven een duidelijker beeld van hoe koralen verwant zijn
- Is roest een enkel cellled organisme?
- Opkomst van chiraliteit en structurele complexiteit in eenkristallen op moleculair en morfologisch niveau

- Hoppig bier zonder ontploffende flessen en te veel alcohol
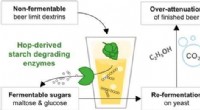
- Water was een winnaar in het opvangen van koolstofdioxide

- Programmeer pH:nieuwe techniek kan DNA-synthese versnellen

- Nauwkeurige en efficiënte dynamische rekenstrategie voor heterogene katalyse
 Wat is verantwoordelijk voor elektriciteit?
Wat is verantwoordelijk voor elektriciteit?  Hoe helpt isolatie tussen de buiten- en binnenmuren van een huis de overdracht van thermische energie te verminderen?
Hoe helpt isolatie tussen de buiten- en binnenmuren van een huis de overdracht van thermische energie te verminderen?  Is natriumchloride anders dan een metaal als elektrische geleider?
Is natriumchloride anders dan een metaal als elektrische geleider?  Zijn voertuigen ontworpen met zowel plastic als elastische waarden om energie te absorberen?
Zijn voertuigen ontworpen met zowel plastic als elastische waarden om energie te absorberen?  Het bepalen van de timing van de evolutie van methanogeen
Het bepalen van de timing van de evolutie van methanogeen Wat vormde de marge van Afrika?
Wat vormde de marge van Afrika?  Wat hebben de sterren te maken met kernenergie?
Wat hebben de sterren te maken met kernenergie?  Wat doet de zwaartekracht tussen twee massieve bollen?
Wat doet de zwaartekracht tussen twee massieve bollen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

