
Wetenschap
Welke heeft polaire covalente bindingen Cl2 Cao N2 of SO2?
* Polaire covalente bindingen: Optreden wanneer twee atomen met verschillende elektronegativiteit elektronen delen. Het meer elektronegatief atoom trekt de gedeelde elektronen dichterbij, waardoor een gedeeltelijke negatieve lading (8) ontstaat op dat atoom en een gedeeltelijke positieve lading (Δ+) op het andere atoom.
Laten we elk molecuul analyseren:
* CL₂ (chloorgas): Chlooratomen hebben dezelfde elektronegativiteit. De binding is niet -polair covalent.
* Cao (calciumoxide): Calcium is een metaal en zuurstof is een niet -metaal. Dit vormt een ionische binding, geen polaire covalente binding.
* n₂ (stikstofgas): Stikstofatomen hebben dezelfde elektronegativiteit. De binding is niet -polair covalent.
* So₂ (zwaveldioxide): Zwavel en zuurstof hebben verschillende elektronegativiteiten (zuurstof is meer elektronegatief). Dit creëert polaire covalente bindingen tussen zwavel en elk zuurstofatoom.
Daarom heeft So₂ (zwaveldioxide) polaire covalente bindingen.
 De krachten van aantrekkingskracht tussen twee objecten variëren met welke factoren?
De krachten van aantrekkingskracht tussen twee objecten variëren met welke factoren?  VK warmer en natter door klimaatverandering:studie
VK warmer en natter door klimaatverandering:studie Beschrijf het Green House -effect en op het klimaat?
Beschrijf het Green House -effect en op het klimaat?  Hoe röntgenstralen hielpen bij het oplossen van het mysterie van drijvende rotsen
Hoe röntgenstralen hielpen bij het oplossen van het mysterie van drijvende rotsen De zeeën komen ons tegemoet in Kiribati. Zal Australië ons herplaatsen?
De zeeën komen ons tegemoet in Kiribati. Zal Australië ons herplaatsen?
Hoofdlijnen
- 25 soorten onthuld voor 25 Genomes Project
- Hoeveel chromosomen zitten er in een menselijke eiercel?
- Wat zijn enkele wetenschapswoorden die beginnen met I?
- Wat is het kenmerk van de Haracteristische Wetenschap van de wetenschap?
- Wat is een weefselplasminogeenactivator A?
- Wat is de locatie van het produceren van ribosomaal RNA?
- Welke ziekten worden veroorzaakt door spiraalvormige bacteriën?
- Oud DNA brengt ons dichter bij het ontsluiten van de geheimen van hoe de moderne mens is geëvolueerd
- Het genoom van Leishmania onthult hoe deze parasiet zich aanpast aan veranderingen in de omgeving
- Succes bij het synthetiseren van zwarte fosfor met een veilige en hoogproductieve methode voor kunstmatige fotosynthese

- De metaalindustrie staat op het punt een van de grootste omwentelingen in de geschiedenis te ondergaan, deskundige zegt:

- Nieuwe technologie voor enzymontwerp
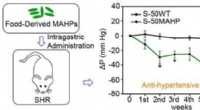
- Transgene rijst verlaagt de bloeddruk van hypertensieve ratten
- Nieuwe klasse katalysatoren voor energieconversie

 Uitvinder van het spijkergeweer
Uitvinder van het spijkergeweer  Hoe zit het met de mysterieuze lichtpuntjes van Ceres? Antwoord wazig, vraag het later opnieuw
Hoe zit het met de mysterieuze lichtpuntjes van Ceres? Antwoord wazig, vraag het later opnieuw  Voerrelaties in ecosystemen worden het best vertegenwoordigd door wat?
Voerrelaties in ecosystemen worden het best vertegenwoordigd door wat?  astronomen onderzoeken sterrenhoop KMHK 1762 in de Grote Magelhaense Wolk
astronomen onderzoeken sterrenhoop KMHK 1762 in de Grote Magelhaense Wolk Welke dieren leven in het dennenbos?
Welke dieren leven in het dennenbos?  Waarom zijn krachten in balans wanneer een auto met gestage snelheid reist?
Waarom zijn krachten in balans wanneer een auto met gestage snelheid reist?  De gesynchroniseerde dans van skyrmion draait
De gesynchroniseerde dans van skyrmion draait Is benzoëzuur sterker dan HCl?
Is benzoëzuur sterker dan HCl?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

