
Wetenschap
Welke verbindingen zijn de meest stabiele AGCI CUCI2 AICI3 of LICI?
factoren die stabiliteit beïnvloeden
* ionisch karakter: Verbindingen met een groter ionisch karakter (een groter verschil in elektronegativiteit tussen het metaal en niet -metaal) zijn over het algemeen stabieler.
* Roosterergie: Hoe sterker de elektrostatische aantrekkingskracht tussen ionen in het kristalrooster, hoe stabieler de verbinding. Roosterergie neemt toe met hogere ladingen op de ionen en kleinere ionische stralen.
Analyse:
* agcl: Zilverchloride heeft een matig ionisch karakter.
* CUCL2: Koper (II) chloride heeft een hoger ionisch karakter dan AGCL vanwege de +2 lading op koper.
* alcl3: Aluminiumchloride heeft een hoog ionisch karakter, maar aluminium is een relatief klein ion, wat kan leiden tot een covalent karakter.
* licl: Lithiumchloride heeft het hoogste ionische karakter vanwege de kleine omvang van het lithiumion en het grote elektronegativiteitsverschil.
Conclusie:
Op basis van deze factoren is licl de meest stabiele verbinding van de vier.
Aanvullende opmerkingen:
* Covalent teken: Hoewel we ons hebben gericht op ionisch karakter, kan de mate van covalente karakter ook de stabiliteit beïnvloeden. ALCL3 heeft bijvoorbeeld een covalent karakter vanwege de kleine omvang van aluminium, waardoor het minder stabiel kan zijn dan verwacht uitsluitend op basis van ionisch karakter.
* Experimentele gegevens: Uiteindelijk kunnen experimentele gegevens (zoals Enthalpy of Formation) de meest nauwkeurige maatstaf voor stabiliteit bieden.
Laat het me weten als je meer informatie wilt over een van deze factoren!
 Molaire verdampingswarmte berekenen
Molaire verdampingswarmte berekenen  Waar zijn de eigenschappen van compound van afhankelijk?
Waar zijn de eigenschappen van compound van afhankelijk?  Wat is de evenwichtige chemische vergelijking van het oplossen van ammoniumnitraat en ladingen op twee productionen?
Wat is de evenwichtige chemische vergelijking van het oplossen van ammoniumnitraat en ladingen op twee productionen?  Nieuwe berekeningsaanpak maakt nauwkeurigere voorspellingen mogelijk van hoe atomen ioniseren wanneer ze worden beïnvloed door hoogenergetische elektronen
Nieuwe berekeningsaanpak maakt nauwkeurigere voorspellingen mogelijk van hoe atomen ioniseren wanneer ze worden beïnvloed door hoogenergetische elektronen  In welke elementen op het periodiek systeem worden bepaalde kenmerken van metalen en niet-metalen gecategoriseerd?
In welke elementen op het periodiek systeem worden bepaalde kenmerken van metalen en niet-metalen gecategoriseerd?
 Multi-tasking klei kan bodemverontreiniging opruimen
Multi-tasking klei kan bodemverontreiniging opruimen De milieuscorekaart van Australië uit 2017:hoge temperaturen zorgen voor nog meer stress voor ecosystemen
De milieuscorekaart van Australië uit 2017:hoge temperaturen zorgen voor nog meer stress voor ecosystemen Burgemeester van New York richt zich op klassieke wolkenkrabbers met Green New Deal
Burgemeester van New York richt zich op klassieke wolkenkrabbers met Green New Deal Frankrijk markeert de heetste naoorlogse junidag terwijl Europa bruist
Frankrijk markeert de heetste naoorlogse junidag terwijl Europa bruist De 3 soorten bacterien
De 3 soorten bacterien
Hoofdlijnen
- Depolarisatie en herpolarisatie van het celmembraan
- Zijn plastiden gevonden in dierlijke cellen?
- Welk idee van gebaseerd op fossiel en de moderne organismen die hij in feite heeft gevonden, zegt in feite dat genetische veranderingen door latere generaties worden geërfd?
- Wie heeft de moderne evolutietheorie opgericht?
- Is centriolen in dierencel de resaSon waarom plant is verschillend met mitose it?
- Hoe evolutie werkt
- Branden vuurspuwende draken hun tanden?
- Wat is forensische genetische genealogie? De techniek die in de zaak Rachel Morin werd gebruikt, is nauwelijks gereguleerd
- Waarom wordt de afzonderlijke typenhypothese door de meeste biologen zo onwaarschijnlijk beschouwd?
- Nieuwe 2D-legering combineert vijf metalen, breekt koolstofdioxide af
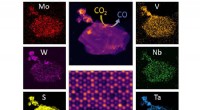
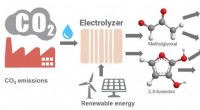
- Hoe klimaatveranderende koolstofdioxide om te zetten in plastic en andere producten?
- Synthetisch gelatineachtig materiaal bootst de rek en sterkte van de onderbuik van kreeft na
- Nieuw textiel kan je koel houden in de hitte, warm in de kou

- Onderzoek zou assemblagelijnsynthese van veelvoorkomende aminebevattende medicijnen mogelijk kunnen maken

 Wat is de chemische formule voor magnesium telluride?
Wat is de chemische formule voor magnesium telluride?  Laserlus koppelt kwantumsystemen over een afstand
Laserlus koppelt kwantumsystemen over een afstand Hoge niveaus van scandium in de buurt van het gigantische zwarte gat van de melkweg waren een illusie, astronomen vinden
Hoge niveaus van scandium in de buurt van het gigantische zwarte gat van de melkweg waren een illusie, astronomen vinden Naar welke energieën zullen we worden getroffen als we opvallen in de zon?
Naar welke energieën zullen we worden getroffen als we opvallen in de zon?  Burgerwetenschappers worden pittig om de door bosbranden geteisterde omgeving in de gaten te houden
Burgerwetenschappers worden pittig om de door bosbranden geteisterde omgeving in de gaten te houden Hoe kleurt licht perzikschillen rood?
Hoe kleurt licht perzikschillen rood? Inzicht in verliesprocessen in perovskietzonnecellen maakt efficiëntieverbeteringen mogelijk
Inzicht in verliesprocessen in perovskietzonnecellen maakt efficiëntieverbeteringen mogelijk De zoektocht naar efficiëntie in thermo-elektrische nanodraden
De zoektocht naar efficiëntie in thermo-elektrische nanodraden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

