
Wetenschap
Beschrijf de algemene locatie van elektronen in een covalente binding?
Hier is een meer gedetailleerde uitleg:
* Atomische orbitalen: Voordat u zich bindt, bevinden elektronen zich in atomaire orbitalen rond elk atoom.
* Overlappende orbitalen: Tijdens de vorming van covalente bindingen overlappen atomaire orbitalen van verschillende atomen. Deze overlapping creëert een nieuwe, gedeeld orbitaal, genaamd een moleculaire orbital .
* Gedeelde elektronendichtheid: De elektronen in de gedeelde moleculaire orbital zijn gedelokaliseerd tussen de twee atomen. Ze brengen tijd door rond beide kernen, en dragen bij aan de aantrekkelijke kracht die de atomen bij elkaar houdt.
* bindingsregio: Het gebied van de ruimte waar de elektronendichtheid het hoogst is in het gedeelde moleculaire orbitaal wordt het bindingsgebied genoemd . Het is waar de elektronen het meest waarschijnlijk worden gevonden en waar de atomen het sterkst tot elkaar worden aangetrokken.
Daarom bevindt de algemene locatie van elektronen in een covalente binding zich in het gebied van ruimte tussen de twee gebonden atomen, in de binding orbital.
 COVID-ademtesten - zou het de volgende kunnen zijn? Onderzoek zegt ja
COVID-ademtesten - zou het de volgende kunnen zijn? Onderzoek zegt ja Elementen in planten gebruiken om de efficiëntie van de brandstofcel te verhogen en tegelijkertijd de kosten te verlagen
Elementen in planten gebruiken om de efficiëntie van de brandstofcel te verhogen en tegelijkertijd de kosten te verlagen Is een vlamkleur een chemisch kenmerk?
Is een vlamkleur een chemisch kenmerk?  Welk ligandsysteem aanwezig in vitamine B 12?
Welk ligandsysteem aanwezig in vitamine B 12?  Is kolen en aardgas hetzelfde?
Is kolen en aardgas hetzelfde?
Hoofdlijnen
- Wat doet ethanol in een DNA-extractie?
- Wat zijn natuurlijke polymeren?
Enkele van de meest voorkomende voorbeelden van polymeren zijn kunststoffen en eiwitten. Hoewel plastics het resultaat zijn van het industriële proces, zijn eiwitten rijk aan aard en worden ze daarom meestal als een
- Is ooggrootte gerelateerd aan genetica of omgeving?
- Wat ontstond er als eerste:een behendige hand of een behendige voet?
- Hoe denken wetenschappers dat protobionts zijn gevormd?
- Cryo-EM-beeldvorming suggereert hoe de dubbele helix scheidt tijdens replicatie
- Stuctuur van een celmembraan
- Wat is een fundamentele levensvorm die toevallig voortkomt uit niet-levende materie, een definitie van .?
- Wat deed de hypothese in Quicksand?
- Doorbraak in chemische synthese houdt belofte in voor toekomstige antibiotica
- Saffieren tonen hun ware kleuren:niet waterminnend
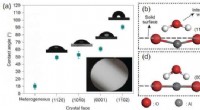
- Sneller kooldioxide afbreken, goedkoper, en efficiënter
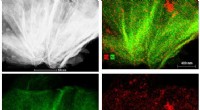
- Een onderzoeksteam ontwikkelt biotransistoren die de kleinste signalen kunnen detecteren

- De ultrastructuur van hout nabootsen met 3D-printen voor groene producten

 Waar kan ik steen krijgen?
Waar kan ik steen krijgen?  Verslag:Jongeren die betrokken zijn bij justitie ervaren mentale en psychologische uitdagingen
Verslag:Jongeren die betrokken zijn bij justitie ervaren mentale en psychologische uitdagingen Wat is de naam van een molecuul met twee zwavelatomen?
Wat is de naam van een molecuul met twee zwavelatomen?  Deadlines voor het recyclen van kunststoffen dreigen - zullen bedrijven hun doelen bereiken?
Deadlines voor het recyclen van kunststoffen dreigen - zullen bedrijven hun doelen bereiken? Metalen die minder reactief zijn Aklitlsnd alkalische aardmetalen genoemd?
Metalen die minder reactief zijn Aklitlsnd alkalische aardmetalen genoemd?  Ontdekking van een nieuwe vloeistof-vloeistof grensvlakvervorming door gedeeltelijke mengbaarheid
Ontdekking van een nieuwe vloeistof-vloeistof grensvlakvervorming door gedeeltelijke mengbaarheid Cebit 2015:Ontdek wat uw apps werkelijk doen
Cebit 2015:Ontdek wat uw apps werkelijk doen  Moet onze grootste angst voor klimaatverandering zichzelf zijn?
Moet onze grootste angst voor klimaatverandering zichzelf zijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

