
Wetenschap
Wat is de volledige ionische vergelijking voor NaOH (aq) HCl (aq) H2O (l) NaCl (aq)?
1. Identificeer de sterke elektrolyten:
* NaOH (aq): Natriumhydroxide is een sterke basis, wat betekent dat het volledig ioniseert in oplossing.
* HCl (aq): Hydrochloorzuur is een sterk zuur, ook volledig ioniseren in oplossing.
* NaCl (aq): Natriumchloride is een oplosbaar zout, dus het dissocieert volledig in oplossing.
2. Schrijf de volledige ionische vergelijking:
Breek de sterke elektrolyten af in hun respectieve ionen:
* NaOH (aq) → Na + (aq) + oh- (aq)
* HCl (aq) → h + (aq) + cl- (aq)
* NaCl (aq) → Na + (aq) + cl- (aq)
3. Combineer de ionen en neem water op:
Na + (aq) + oh- (aq) + h + (aq) + cl- (aq) → h2o (l) + na + (aq) + cl- (aq)
4. Scheiding ionen annuleren:
Toeschouwersionen zijn die die aan beide zijden van de vergelijking verschijnen en niet deelnemen aan de reactie. In dit geval zijn Na+ en Cl- toeschouwersionen.
Laatste volledige ionische vergelijking:
oh- (aq) + h + (aq) → h2o (l)
 Microplastics in de Oostzee zijn al 30 jaar niet meer gestegen
Microplastics in de Oostzee zijn al 30 jaar niet meer gestegen Welke eigenschap wordt toegeschreven aan de deeltjeskarakter van licht in plaats van de golfkarakter?
Welke eigenschap wordt toegeschreven aan de deeltjeskarakter van licht in plaats van de golfkarakter?  Oude relikwie wijst op een keerpunt in de geschiedenis van de aarde 42, 000 jaar geleden
Oude relikwie wijst op een keerpunt in de geschiedenis van de aarde 42, 000 jaar geleden Onderzoekers voorspelden een iets bovengemiddeld Atlantisch orkaanseizoen 2018
Onderzoekers voorspelden een iets bovengemiddeld Atlantisch orkaanseizoen 2018 Holistische studie van kustecosysteem onthult snelle reactie op klimaatverandering
Holistische studie van kustecosysteem onthult snelle reactie op klimaatverandering
Hoofdlijnen
- Overeenkomsten tussen verbranding en cellulaire ademhaling
- Wat is grafiek in de wetenschap?
- Onderzoekers onderzoeken de complexe interacties tussen hout, houtkap en bosolifanten
- Welk molecuul gebruiken zoogdieren om extra glucose in hun spieren op te slaan?
- Wat betekent afweging in de wetenschapstermijn?
- Waarom hebben planten een gezond wortelsysteem nodig voor fotosynthese?
- Wanneer het ene gen zich boven het andere uitdrukt, wordt gezegd dat het eerste DNA is?
- Wat is de functie van lymfeklieren?
- Groep organen wordt een genoemd?
- Hoe oud is die vingerafdruk?

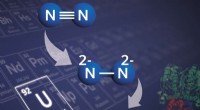
- Een op uranium gebaseerde verbinding verbetert de productie van stikstofproducten
- Dominerende schimmel zou een oplossing kunnen zijn om meer biobrandstoffen en chemicaliën te produceren
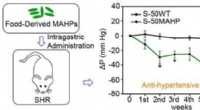
- Transgene rijst verlaagt de bloeddruk van hypertensieve ratten
- Veldgevoelige mechanische metamaterialen (FRMM's)

 De constante versnelling van een object dat in een cirkel beweegt, wordt aangeroepen?
De constante versnelling van een object dat in een cirkel beweegt, wordt aangeroepen?  Welke organismen profiteren van de relatie tussen ossenpikker en nijlpaard?
Welke organismen profiteren van de relatie tussen ossenpikker en nijlpaard?  De grote vlaktes worden ook wel genoemd?
De grote vlaktes worden ook wel genoemd?  Flexibele en transparante druksensor
Flexibele en transparante druksensor Wat is CUSOH2O?
Wat is CUSOH2O?  Hoe de consistente inkomsten van een bedrijf ervoor kunnen zorgen dat de CEO wordt ontslagen
Hoe de consistente inkomsten van een bedrijf ervoor kunnen zorgen dat de CEO wordt ontslagen  Wat verklaart waarom koolstof zo’n veelzijdig element is?
Wat verklaart waarom koolstof zo’n veelzijdig element is?  Wat heeft het zaad nodig om energie uit zaad vrij te maken?
Wat heeft het zaad nodig om energie uit zaad vrij te maken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

