
Wetenschap
Wat is de covalente binding voor chloor en chloor?
* Chloor's valentie -elektronen: Chloor heeft 7 valentie -elektronen (elektronen in de buitenste schaal). Om een stabiel octet (8 elektronen) te bereiken, heeft het nog een elektron nodig.
* Elektronen delen: Wanneer twee chlooratomen binden, delen ze elk een van hun valentie -elektronen. Dit creëert een gedeeld paar elektronen, dat beide chlooratomen tellen als onderdeel van hun octet.
* Niet -polaire covalente binding: De gedeelde elektronen worden gelijkelijk aangetrokken tot beide chlooratomen, wat resulteert in een niet -polaire covalente binding.
Hier is een vereenvoudigde weergave:
* Cl + Cl → Cl-Cl
Dit gedeelde paar elektronen creëert een stabiele binding tussen de twee chlooratomen, die een chloormolecuul vormt (CL 2 ).
 Arctische vergroening ontdooit permafrost, verhoogt de afvoer
Arctische vergroening ontdooit permafrost, verhoogt de afvoer Van ijsberen tot grondwater, de natuur is bezaaid met eeuwige chemicaliën
Van ijsberen tot grondwater, de natuur is bezaaid met eeuwige chemicaliën  UITLEG:Hoe de opwarming het Arctische zee-ijs en ijsberen beïnvloedt
UITLEG:Hoe de opwarming het Arctische zee-ijs en ijsberen beïnvloedt  Noord-Atlantische Oceaan wordt minder zout, maar het is te vroeg om klimaatverandering de schuld te geven
Noord-Atlantische Oceaan wordt minder zout, maar het is te vroeg om klimaatverandering de schuld te geven Klimaatslimme landbouw vereist radicale beleidswijzigingen
Klimaatslimme landbouw vereist radicale beleidswijzigingen
Hoofdlijnen
- Zijn de genen in dochtercellen geproduceerd door mitosen hetzelfde als of verschillend van de originele cel?
- Onderzoekers beschrijven voor het eerst hoe sommige bacteriën mannen doden:ze dringen de moeder binnen
- Onderzoekers beschrijven allereerste hybride vogelsoorten uit de Amazone
- Wat zijn niet-edelbare planten?
- Onderscheid maken tussen pathogene deficiëntie erfelijke en fysiologische ziekte?
- Hoe komt bacteriën daar eten?
- Hoe dienen de stikstofbasen langs een gen als genetische code?
- Welke cellen hebben peptidoglycan?
- Nieuwe biobronnen voor plantaardige peptidehormonen met behulp van technologie voor het bewerken van genen
- Tegengestelde actie zou de industriële gasscheiding kunnen verbeteren
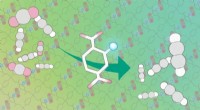
- Poreus kristal leidt reactie om koolstofdioxide te transformeren

- Een gesloten kooi-achtig molecuul dat kan worden geopend
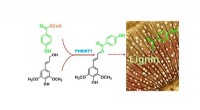
- Wetenschappers ID-enzym voor het maken van belangrijke industriële chemicaliën in planten
- Chemie digitaliseren met een slimme roerstaaf

 Wat is het ‘oudste dochtersyndroom’ en hoe kunnen we dit verhelpen?
Wat is het ‘oudste dochtersyndroom’ en hoe kunnen we dit verhelpen?  Waarom wordt de maan niet beschouwd als een lichtbron?
Waarom wordt de maan niet beschouwd als een lichtbron?  Zijn gras- en fruit levende organismen?
Zijn gras- en fruit levende organismen?  Wat was Einsteins inspiratie om relativiteitstheorie te maken?
Wat was Einsteins inspiratie om relativiteitstheorie te maken?  Welk item is ontworpen om elektrische energie te veranderen in warmte -energie?
Welk item is ontworpen om elektrische energie te veranderen in warmte -energie?  Waarom is de El Nino-Zuidelijke Oscillatie sinds 2000 moeilijker te voorspellen?
Waarom is de El Nino-Zuidelijke Oscillatie sinds 2000 moeilijker te voorspellen? Eerste celkaart van 20, 000 cellen in zoogdierembryo
Eerste celkaart van 20, 000 cellen in zoogdierembryo Welke input- en output-energie wordt er gebruikt als er brand is?
Welke input- en output-energie wordt er gebruikt als er brand is?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

