
Wetenschap
Welk volume zuurstof bij 350 graden Celsius en een druk 5.25ATM is nodig om 5,00 g zwaveltrioxide volledig om te zetten?
1. Schrijf de gebalanceerde chemische vergelijking:
De reactie tussen zwaveltrioxide (SO₃) en zuurstof (O₂) om zwaveldioxide (SO₂) te vormen, is:
2 so₃ (g) + o₂ (g) → 2 so₂ (g)
2. Bereken de mol van SO₃:
* Molaire massa van SO₃ =80,06 g/mol
* Mol So₃ =(5,00 g) / (80,06 g / mol) =0,0625 mol
3. Bepaal de mol O₂ vereist:
* Uit de evenwichtige vergelijking reageren 2 mol SO₃ met 1 mol o₂.
* Mol O₂ nodig =(0,0625 mol So₃) * (1 mol O₂ / 2 mol So₃) =0,03125 mol O₂
4. Breng de ideale gaswet aan om het volume van O₂ te vinden:
* Ideale gaswet:PV =NRT
* P =druk =5,25 atm
* V =volume (wat we willen vinden)
* n =mol o₂ =0,03125 mol
* R =ideale gasconstante =0,0821 l · atm/mol · k
* T =temperatuur =350 ° C + 273.15 =623.15 K
5. Oplossen voor V:
* V =(nrt) / p
* V =(0,03125 mol * 0,0821 l · atm / mol · k * 623.15 k) / 5,25 atm
* V ≈ 0,308 l
Daarom zijn ongeveer 0,308 liter zuurstofgas nodig bij 350 ° C en 5,25 atm om 5,00 gram zwaveltrioxide volledig om te zetten.
 Klimaatverandering zal naar verwachting de schadelijke algenbloei in zoetwater in de VS aanzienlijk doen toenemen
Klimaatverandering zal naar verwachting de schadelijke algenbloei in zoetwater in de VS aanzienlijk doen toenemen Mondiale oceaantop levert 10 miljard dollar aan toezeggingen op:Griekse premier
Mondiale oceaantop levert 10 miljard dollar aan toezeggingen op:Griekse premier  Wat voor soort objecten maken een schaduw?
Wat voor soort objecten maken een schaduw?  Een beter wapen bouwen tegen schadelijke algenbloei
Een beter wapen bouwen tegen schadelijke algenbloei Wat ligt er onder een vulkaan?
Wat ligt er onder een vulkaan?
Hoofdlijnen
- Wat zijn de vrouwelijke gameten geproduceerd in niet-vasculaire planten?
- Invasieve superschurkenkrab kan door zijn kieuwen heen eten
- Wat is het directe resultaat van aerobe ademhaling?
- Wat moet er gebeuren met de DNA-strengen in de kern voordat de cel kan delen?
- Waar zijn stamcellen gevestigd?
- Wie heeft het woord noggin uitgevonden?
- Hoe bacteriële cellen hun eigen DNA herkennen
- Wat zijn de juiste componenten van wetenschappelijke methoden?
- Waarom wordt een elektronenmicroscoop gebruikt om virussen te zien?
- Gebruikmaken van de structuur van bacteriële gastheercelreceptoren om kanker te detecteren
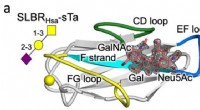
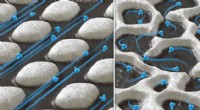
- Met water over nanosnelwegen rijden
- CRISPR-methode voor voorwaardelijke genregulatie

- Zelfherstellende batterijen:ingenieurs ontwikkelen een manier om batterijen met een hoge capaciteit en een lange levensduur te maken

- Onderzoeker gebruikt canola om biologisch afbreekbare huishoudfolie te maken

 Wat voor soort weer komt voor langs een stilstaand front?
Wat voor soort weer komt voor langs een stilstaand front?  Waarom de Indische Oceaan sterke en dodelijke tropische cyclonen voortbrengt
Waarom de Indische Oceaan sterke en dodelijke tropische cyclonen voortbrengt Wat zijn de volgende termen het beste om het concept te beschrijven dat gesmolten rots voortkomt uit de rand van een bord op aarde korst die de andere kant in geul duwt?
Wat zijn de volgende termen het beste om het concept te beschrijven dat gesmolten rots voortkomt uit de rand van een bord op aarde korst die de andere kant in geul duwt?  Welk molecuul dat wordt geproduceerd tijdens de lichte reactie van fotosynthese is nodig om een donkere reactie te maken?
Welk molecuul dat wordt geproduceerd tijdens de lichte reactie van fotosynthese is nodig om een donkere reactie te maken?  Twee jaar aftellen voor diepzeebodemmijnbouw
Twee jaar aftellen voor diepzeebodemmijnbouw Wat is een pure stoffen?
Wat is een pure stoffen?  Wat zijn de energietransformaties in een kettingzaag?
Wat zijn de energietransformaties in een kettingzaag?  Onderzoek laat zien hoe een enkel enzym de productie van sojaolie kan stimuleren
Onderzoek laat zien hoe een enkel enzym de productie van sojaolie kan stimuleren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

