
Wetenschap
Welke van deze stoffen bevatten moleculen die geen fluoride water of ammoniak van waterstofbruggen vormen?
Inzicht in waterstofbindingen
Waterstofbindingen vormen zich tussen moleculen wanneer een waterstofatoom wordt gebonden aan een sterk elektronegatief atoom (zoals zuurstof, stikstof of fluor) en wordt aangetrokken tot een elektronpaar op een nabijgelegen elektronegatief atoom in een ander molecuul.
Analyse van de stoffen
* fluoride (f-) :Fluoride -ionen zijn negatief geladen en hebben niet de benodigde waterstofatomen om deel te nemen aan waterstofbinding.
* water (h₂o) :Watermoleculen hebben twee waterstofatomen gebonden aan een zuurstofatoom. Deze waterstofatomen kunnen waterstofbruggen vormen met de zuurstofatomen van andere watermoleculen.
* ammoniak (NH₃) :Ammoniakmoleculen hebben drie waterstofatomen gebonden aan een stikstofatoom. Deze waterstofatomen kunnen waterstofbruggen vormen met de stikstofatomen van andere ammoniakmoleculen.
Conclusie
Fluoride (F-) is de stof die geen waterstofbruggen zal vormen.
 Is ammoniumcarbonaat oplosbaar in water?
Is ammoniumcarbonaat oplosbaar in water?  Gebruik maken van generatieve AI om krachtige en selectieve MYT1-remmers te identificeren voor de behandeling van kanker
Gebruik maken van generatieve AI om krachtige en selectieve MYT1-remmers te identificeren voor de behandeling van kanker  Wat gebeurt er als u suiker in water oplost?
Wat gebeurt er als u suiker in water oplost?  Hoeveel radioactieve elementen worden er in het laboratorium gemaakt?
Hoeveel radioactieve elementen worden er in het laboratorium gemaakt?  Wat is de formule van het ion dat wordt gevormd wanneer kalium een edelgas-elektronenconfiguratie bereikt?
Wat is de formule van het ion dat wordt gevormd wanneer kalium een edelgas-elektronenconfiguratie bereikt?
 Offshore olie- en gasplatforms stoten meer methaan uit dan eerder geschat
Offshore olie- en gasplatforms stoten meer methaan uit dan eerder geschat Het einde van de ontbossing in het Braziliaanse Amazonegebied?
Het einde van de ontbossing in het Braziliaanse Amazonegebied?  Mercurius stijgt:studie werpt nieuw licht op de impact van oude vulkanen op het milieu
Mercurius stijgt:studie werpt nieuw licht op de impact van oude vulkanen op het milieu  Uphill battle:Spaanse wijnboeren passen zich aan aan klimaatverandering
Uphill battle:Spaanse wijnboeren passen zich aan aan klimaatverandering Vergroening op hoge breedtegraden kan de uitbreiding van woestijnen op gemiddelde breedtegraden remmen
Vergroening op hoge breedtegraden kan de uitbreiding van woestijnen op gemiddelde breedtegraden remmen
Hoofdlijnen
- Laatste verdedigingslinie:hoe bacteriepopulaties worden beschermd tegen virale infecties
- Chromosomale afwijkingen: wat is het?, Typen en oorzaken
- Wat is het orgel dat de meeste stollingsfactoren synthetiseert?
- Hoe helpt M -eiwit Streptococcus pyogenes fagocyten ontwijken?
- Welk organel vangt de energie van zonlicht op en zet deze om in een chemische stof in de vorm van glucose?
- Wat is de officiële naam van de kleinste en eenvoudigste cellen?
- Biologen onthullen hoe gyrase DNA-verstrengelingen oplost
- Wordt stikstof gevonden in koolhydraten of lipiden -eiwitten?
- Hoe kan een persoon planten- en dierlijke cellen identificeren?
- Nieuwe strategie voor isotopenscheiding met flexibel poreus materiaal
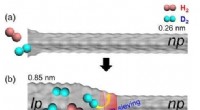
- Het bereiken van stabiele K-opslagprestaties van met koolstofbolletjes opgesloten antimoon via elektrolytregulatie
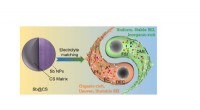
- Video:Caesars laatste adem en Einsteins koelkast kwijt

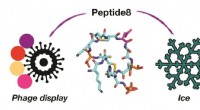
- Fagen gebruiken om nieuwe antivries-eiwitten te ontdekken
- Elektrochemische reductie van kooldioxide tot ethanol

 Bredere opwaartse stromingen bij zware stormen kunnen de kans op schadelijke hagel vergroten
Bredere opwaartse stromingen bij zware stormen kunnen de kans op schadelijke hagel vergroten Hoe beïnvloeden convectie en straling van de geleiding de bewegingstemperatuur van de lucht in de buurt van de oceaan?
Hoe beïnvloeden convectie en straling van de geleiding de bewegingstemperatuur van de lucht in de buurt van de oceaan?  Waar kan zonne -energie worden gevonden?
Waar kan zonne -energie worden gevonden?  Welke wet reaat versnelling aan de massa?
Welke wet reaat versnelling aan de massa?  Welk type grens is de Juan de Fuca -plaat?
Welk type grens is de Juan de Fuca -plaat?  Wat gebeurt er ondergronds tijdens hydrofracturering?
Wat gebeurt er ondergronds tijdens hydrofracturering? Erfgoedwetenschap:waar het verleden naar de toekomst kijkt
Erfgoedwetenschap:waar het verleden naar de toekomst kijkt Onderzoekers ontwikkelen sensor om hersenaandoeningen in seconden te detecteren
Onderzoekers ontwikkelen sensor om hersenaandoeningen in seconden te detecteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

