
Wetenschap
Wat bevat coördinaten covalente bindingen HCl HFL H20 of H30 1?
Coördineren covalente bindingen
* Een coördinaatcovalente binding (ook wel een dative binding genoemd) treedt op wanneer één atoom beide elektronen bijdraagt aan het gedeelde paar in een binding.
* Het elektronenpaar wordt geschonken van een eenzaam paar op het ene atoom aan een leeg orbitaal op het andere atoom.
Analyse van de moleculen:
* HCl (waterstofchloride): Dit is een normale covalente binding, waarbij elk atoom één elektron bijdraagt.
* HF (waterstoffluoride): Dit is ook een normale covalente binding.
* h₂o (water): Water bevat normale covalente bindingen tussen de zuurstof- en waterstofatomen. Het is echter belangrijk om te begrijpen dat het zuurstofatoom in water twee eenzame paar elektronen heeft. Dit maakt water tot een goede elektronendonor bij het vormen van coördinatencovalente bindingen.
* h₃o⁺ (hydroniumion): Hier vinden we de coördinaat covalente binding!
* Formatie: H₃o⁺ wordt gevormd wanneer een watermolecuul (H₂o) een proton (H⁺) van een zuur accepteert.
* binding: Het proton (H⁺) heeft een leeg orbitaal. Een van de enige paren op het zuurstofatoom in water vormt een coördinatencovalente binding met deze lege orbitaal.
Conclusie:
* h₃o⁺ (hydroniumion) bevat een coördinaatcovalente binding.
Laat het me weten als je meer uitleg wilt over een van deze moleculen!
 Wat is de elementaire samenstelling van een mix van natronkalk en zetmeel?
Wat is de elementaire samenstelling van een mix van natronkalk en zetmeel?  Hoe warmteverlies te berekenen tijdens drukontlading in de pijpleiding
Hoe warmteverlies te berekenen tijdens drukontlading in de pijpleiding Wetenschappers onderzoeken hoe katalysatoren met één atoom de waterzuivering beïnvloeden in een geavanceerd oxidatieproces
Wetenschappers onderzoeken hoe katalysatoren met één atoom de waterzuivering beïnvloeden in een geavanceerd oxidatieproces  Hoe ziet een correct Bohr -model van platina eruit?
Hoe ziet een correct Bohr -model van platina eruit?  Welke intermoleculaire kracht zou het smeltpunt het minst beïnvloeden? Ionische bindingen Van der Waals forceert waterstofbruggen of dipool-dipoolinteracties?
Welke intermoleculaire kracht zou het smeltpunt het minst beïnvloeden? Ionische bindingen Van der Waals forceert waterstofbruggen of dipool-dipoolinteracties?
 Hoe heet de bodem van het regenwoud?
Hoe heet de bodem van het regenwoud?  Onderzoekers verbinden de huidige mix van bodembacteriën met klimaatomstandigheden van 50 jaar geleden
Onderzoekers verbinden de huidige mix van bodembacteriën met klimaatomstandigheden van 50 jaar geleden De 17e grote Atlantische storm krijgt vorm in het drukke seizoen
De 17e grote Atlantische storm krijgt vorm in het drukke seizoen Naaldbomen hebben geen bloemen, waar worden hun zaden van gemaakt?
Naaldbomen hebben geen bloemen, waar worden hun zaden van gemaakt?  Een nieuw algoritme voorspelt de moeilijkheid bij het bestrijden van brand
Een nieuw algoritme voorspelt de moeilijkheid bij het bestrijden van brand
Hoofdlijnen
- Maki's klagen:wanneer de ene kwetsbare soort de andere besluipt
- Hoe bereikt de mannelijke gameet de vrouwelijke gameet in planten?
- Wordt DNA op zijn 2 -positie afgebroken?
- Wat is het tegenovergestelde van DNA?
- Wat is de wetenschappelijke naam van vuuralgen?
- Verplaatste haviken gedijen goed in Hispaniola
- In welke stap zou een mutatie rechtstreeks leiden tot de vorming van een veranderd gen -?
- 3D-simulatie laat zien hoe de vorm van complexe organen evolueert door natuurlijke selectie
- Welk deel van de gastheer eten bacteriën en virussen?
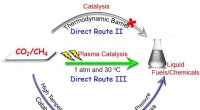
- Doorbraak in directe activering van CO2 en CH4 tot vloeibare brandstoffen en chemicaliën
- Smartphone-testplekken vergiftigd waterrisico voor miljoenen levens

- Krachtige laserdiodes kunnen restspanning in 3D-geprinte metalen onderdelen verminderen

- Kunnen we plastic tassen recyclen tot stoffen van de toekomst?

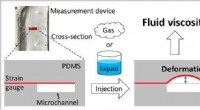
- Onderzoekers ontwikkelen een viscositeitsmeettechniek voor zowel vloeistoffen als gassen
 Gefuseerde beeldvorming onthult zesde-eeuws schrift verborgen in boekbinden
Gefuseerde beeldvorming onthult zesde-eeuws schrift verborgen in boekbinden Hoeveel graden naar het zuiden is Engeland van de evenaar?
Hoeveel graden naar het zuiden is Engeland van de evenaar?  Tesla start community college-cursussen om technici op te leiden
Tesla start community college-cursussen om technici op te leiden Wat zijn voorbeelden van minerale hulpbronnen?
Wat zijn voorbeelden van minerale hulpbronnen?  Leger is van plan de ontdekking van nanogalvanisch aluminiumpoeder in licentie te geven
Leger is van plan de ontdekking van nanogalvanisch aluminiumpoeder in licentie te geven Trofische coherentie verklaart waarom netwerken weinig feedbackloops en een hoge stabiliteit hebben
Trofische coherentie verklaart waarom netwerken weinig feedbackloops en een hoge stabiliteit hebben Onderzoekers bestuderen de lange geschiedenis van onthoofdingen en verfaanvallen op openbare standbeelden in Nieuw-Zeeland
Onderzoekers bestuderen de lange geschiedenis van onthoofdingen en verfaanvallen op openbare standbeelden in Nieuw-Zeeland Doorbraak met zachte druksensor lost de meest uitdagende bottleneck op
Doorbraak met zachte druksensor lost de meest uitdagende bottleneck op
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

