
Wetenschap
Waarom is zwaveldioxide polair en koolstof non wanneer beide covalente binding hebben?
Hier is een uitsplitsing:
zwaveldioxide (So₂):
* Geometrie: Gebogen (of V-vormig)
* polariteit: Polair
* Verklaring: Het zwavelatoom heeft twee zuurstofatomen bevestigd en de enige paren op het zwavelatoom creëren een vervormde geometrie. Deze ongelijke verdeling van elektronendichtheid resulteert in een dipoolmoment, waardoor het molecuul polair wordt.
Koolstofdioxide (CO₂):
* Geometrie: Lineair
* polariteit: Niet -polair
* Verklaring: Het koolstofatoom wordt gebonden aan twee zuurstofatomen met een lineaire geometrie. Het elektronegativiteitsverschil tussen koolstof en zuurstof creëert polaire bindingen in het molecuul. De twee polaire bindingen zijn echter gelijk en tegenover elkaar, waardoor elkaar effectief wordt geannuleerd. Dit resulteert in een niet -polair molecuul.
Key Takeaways:
* Moleculaire geometrie: De vorm van het molecuul speelt een cruciale rol bij het bepalen van polariteit.
* Elektronegativiteitsverschil: Het verschil in elektronegativiteit tussen atomen bepaalt de polariteit van individuele bindingen.
* annulering van dipolen: In symmetrische moleculen, zelfs als individuele bindingen polair zijn, kan het totale molecuul niet -polair zijn vanwege de annulering van dipolen.
Laat het me weten als je nog andere vragen hebt over polariteit en chemische binding!
 Onderzoeksteam stelt een effectieve strategie voor om koolstofnanomaterialen voor te bereiden
Onderzoeksteam stelt een effectieve strategie voor om koolstofnanomaterialen voor te bereiden Microben maken die broeikasgassen transformeren
Microben maken die broeikasgassen transformeren Welk element heeft het laagste kokende en vriespunt?
Welk element heeft het laagste kokende en vriespunt?  Welk type binding wordt gevormd tussen jodium en koolstof?
Welk type binding wordt gevormd tussen jodium en koolstof?  Veelzijdige bouwstenen maken constructies met verrassende mechanische eigenschappen
Veelzijdige bouwstenen maken constructies met verrassende mechanische eigenschappen
 Harde rotsen uit de Himalaya verhogen het overstromingsrisico voor miljoenen
Harde rotsen uit de Himalaya verhogen het overstromingsrisico voor miljoenen De geheimen van de vroege atmosfeer van de aarde ontsluiten
De geheimen van de vroege atmosfeer van de aarde ontsluiten Wetenschappers kijken naar de bodem en leren hoe bossen de luchtkwaliteit en de klimaatverandering beïnvloeden
Wetenschappers kijken naar de bodem en leren hoe bossen de luchtkwaliteit en de klimaatverandering beïnvloeden  Hoeveel is de natuur waard?
Hoeveel is de natuur waard?  Bosherstelacties moeten prioriteit geven aan diversiteit boven schaal voor goedkopere, succes op lange termijn
Bosherstelacties moeten prioriteit geven aan diversiteit boven schaal voor goedkopere, succes op lange termijn
Hoofdlijnen
- Wat vertoont een eenhuizige plant?
- Het ontrafelen van de culinaire geheimen van isopoden en waarom dit belangrijk is voor ecosystemen
- Kunnen katten en coyotes naast elkaar bestaan?
- Welk product is gebruikelijk IT -reacties in cellulaire ademhaling en gisting?
- Onderzoekers ontdekken hoe microben een krachtig antibioticum bouwen
- Wat is een functie van Cell Menbrain?
- Hoe minder eten in het vroege leven zou kunnen helpen bij de voortplanting later
- Waar wordt het paramecium gevonden in een menselijk lichaam?
- Hoe gedraagt een cel zich als mens?
- Wetenschappers identificeren schadelijke bacteriën op basis van hun DNA tegen zeer lage kosten

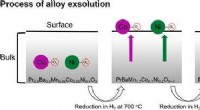
- Hoogwaardige zelf-geassembleerde katalysator voor SOFC
- Video:Waarom exploderen telefoonbatterijen soms?

- Synthese van een zeldzaam metaalcomplex van lachgas opent nieuwe perspectieven voor
- Kun je een malt whisky van 10 jaar maken in weken? De chemie zegt ja

 Als de zon uitgeput van zijn kernenergie, wat zou er dan gebeuren met onze middelen op aarde?
Als de zon uitgeput van zijn kernenergie, wat zou er dan gebeuren met onze middelen op aarde?  Leg uit het gemiddelde, de modus en de mediaan
Leg uit het gemiddelde, de modus en de mediaan Hoe beweegt een slak?
Hoe beweegt een slak?  Wat is de snelheid van de verbranding in zuivere zuurstof met een hoge concentratie vergeleken met lage lucht?
Wat is de snelheid van de verbranding in zuivere zuurstof met een hoge concentratie vergeleken met lage lucht?  Welke dwergplaneet is dichterbij dan Neptunus 10 procent van de tijd?
Welke dwergplaneet is dichterbij dan Neptunus 10 procent van de tijd?  Is vetvrij papier een warmtegeleider?
Is vetvrij papier een warmtegeleider?  Hoe smelt je het element Mercurius?
Hoe smelt je het element Mercurius?  Statistieken over extreme regenval kunnen veranderen naarmate het klimaat in de VS warmer wordt
Statistieken over extreme regenval kunnen veranderen naarmate het klimaat in de VS warmer wordt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

