
Wetenschap
Kies het productmetaaloxide plus niet -metalen æ?
Inzicht in de reactie
* metaaloxiden: Dit zijn verbindingen gevormd door de reactie van een metaal met zuurstof. Ze hebben meestal de algemene formule MO (waarbij m het metaal is). Voorbeelden zijn:
* Natriumoxide (Na₂o)
* IJzer (iii) oxide (fe₂o₃)
* Koperoxide (Cuo)
* niet -metalen: Dit zijn elementen aan de rechterkant van het periodiek systeem. Ze hebben vaak een sterke neiging om elektronen te winnen. Voorbeelden zijn:
* Chloor (Cl₂)
* Zwavel (s)
* Koolstof (C)
* De reactie: Wanneer een metaaloxide reageert met een niet -metaal, werkt het metaaloxide als een basis en werkt het niet -metaal als een zuur. Dit is vaak een redox -reactie waarbij het metaal wordt geoxideerd (verliest elektronen) en het niet -metaal wordt verminderd (winst elektronen). Het resultaat is meestal de vorming van een zout- en zuurstofgas.
Voorbeeld:
Laten we de reactie van ijzer (III) oxide (Fe₂o₃) met chloor (CL₂) bekijken:
* reactanten: Fe₂o₃ (metaaloxide) + Cl₂ (niet -metaal)
* Producten: Fecl₃ (zout) + o₂ (zuurstofgas)
De gebalanceerde chemische vergelijking:
2 Fe₂o₃ + 3 Cl₂ → 4 Fecl₃ + 3 O₂
Key Points
* Niet alle metaaloxiden zullen reageren met alle niet -metalen. U moet rekening houden met de reactiviteit van de specifieke betrokken elementen.
* De reactieomstandigheden (temperatuur, druk) kunnen de uitkomst beïnvloeden.
Laat het me weten als u specifieke metaaloxide/niet -metalen combinaties wilt verkennen of nog meer vragen wilt hebben!
 Waarom is het belangrijk voor uw gezondheid dat verbindingen zijn samengesteld als natriumionen en kalium oplosbaar in water zijn?
Waarom is het belangrijk voor uw gezondheid dat verbindingen zijn samengesteld als natriumionen en kalium oplosbaar in water zijn?  Wat is een voorbeeld van een gas dat rechtstreeks in vaste stof verandert?
Wat is een voorbeeld van een gas dat rechtstreeks in vaste stof verandert?  Wat is depositie in wetenschapsvorm?
Wat is depositie in wetenschapsvorm?  Wat is een beschrijving voor Kinetic?
Wat is een beschrijving voor Kinetic?  Gastro-intestinaal-bewoner, vormveranderende microdevices voor verlengde medicijnafgifte
Gastro-intestinaal-bewoner, vormveranderende microdevices voor verlengde medicijnafgifte
 10 dingen die u kunt doen om de aarde te helpen redden
10 dingen die u kunt doen om de aarde te helpen redden  Waarom Spiderman niet kan bestaan:Gekko's hebben een 'limiet' voor het plakken aan muren
Waarom Spiderman niet kan bestaan:Gekko's hebben een 'limiet' voor het plakken aan muren  De eerste weergave van verwering op angströmschaal
De eerste weergave van verwering op angströmschaal IJslandse vulkaanuitbarsting kan een lange adem zijn
IJslandse vulkaanuitbarsting kan een lange adem zijn West-Afrika:door mensen veroorzaakte luchtvervuiling is hoger dan verwacht
West-Afrika:door mensen veroorzaakte luchtvervuiling is hoger dan verwacht
Hoofdlijnen
- Taxonomie is de wetenschap die zich bezighoudt?
- Wat zijn bèta -deeltjes?
- Mimetolieten:de gezichten die we zien in rotsformaties
- Wat is het verschil tussen dierlijke cellen en plantencellen?
- Onderzoekers ontdekken waarom de ziekteverwekker van buiktyfus zich alleen op mensen richt
- Hoe menselijke cellen de start van DNA-replicatie coördineren
- Een nieuw computermodel onderzoekt hoe eiwitten 'op afstand' worden aangestuurd
- Wat zijn werkpaarden van een cel die in de biologie worden genoemd?
- Biodiversiteit in de marges:Het samenvoegen van landbouwgronden heeft invloed op de natuurlijke plaagbestrijding
- Radicale methoden voor geïnfecteerde implantaten
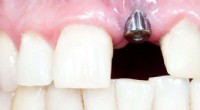
- De kracht van microgolven gebruiken om plastic te recyclen

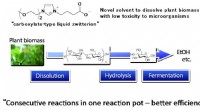
- Nieuw oplosmiddel draagt bij aan de volgende generatie biobrandstofproductie uit biomassa
- Doorbraak bloedmonster goed nieuws voor zwangere vrouwen

- Nieuwe synthetische eiwitten wedijveren met hun natuurlijke tegenhangers in protonentransport

 Studie test de veerkracht van de Salish Sea tegen de gevolgen van klimaatverandering
Studie test de veerkracht van de Salish Sea tegen de gevolgen van klimaatverandering Apple zegt dat Amerikaanse tarieven op China averechts werken
Apple zegt dat Amerikaanse tarieven op China averechts werken Wat is het belang van transport in planten en dieren?
Wat is het belang van transport in planten en dieren?  De Romeinse missie van NASA levert detectoren aan de Japanse PRIME-telescoop
De Romeinse missie van NASA levert detectoren aan de Japanse PRIME-telescoop Het verbranden van fossiele brandstoffen is als het loslaten van een katapult, omdat beide potentiële energie veranderen in wat voor soort energie?
Het verbranden van fossiele brandstoffen is als het loslaten van een katapult, omdat beide potentiële energie veranderen in wat voor soort energie?  Hoe werken aanraakgevoelige lampen?
Hoe werken aanraakgevoelige lampen?  Wat koelt en verhardt onderoppervlak van korst?
Wat koelt en verhardt onderoppervlak van korst?  Welk type binding wordt gevormd wanneer koolstof gecombineerd met broom?
Welk type binding wordt gevormd wanneer koolstof gecombineerd met broom?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

