
Wetenschap
Waarom hydrazine eenvoudiger dan ammoniak?
* Elektronendichtheid: De stikstofatomen in zowel hydrazine als ammoniak hebben een eenzaam paar elektronen, wat verantwoordelijk is voor hun basiciteit. In hydrazine is de elektronendichtheid op het stikstofatoom echter enigszins lager Vanwege de aanwezigheid van het tweede stikstofatoom, dat enige elektronendichtheid kan terugtrekken door de N-N-binding.
* inductief effect: Het elektronen-withend effect van de tweede stikstof in hydrazine, bekend als het inductieve effect, verzwakt de elektronendichtheid op het stikstofatoom, waardoor het minder waarschijnlijk zijn enige elektronen doneert en als basis fungeert.
* PKA -waarden: De PKA -waarden van de conjugaatzuren van deze verbindingen ondersteunen deze observatie verder. De PKA van het ammoniumion (NH₄⁺) is 9,25, terwijl de PKA van het hydraziniumion (n₂h₅⁺) 8.1 is. Een hogere PKA geeft een zwakker zuur aan, wat betekent dat de overeenkomstige basis (ammoniak in dit geval) sterker is.
Daarom is ammoniak eenvoudiger dan hydrazine.
Het is belangrijk om te onthouden dat de sterkte van een basis afhangt van zijn vermogen om elektronen te doneren en een binding te vormen met een proton (H⁺). Hoewel zowel ammoniak als hydrazine een eenzaam paar elektronen hebben, maken de elektronendichtheid en het inductieve effect in hydrazine het minder effectief bij het doneren van die elektronen en werken als basis.
 Welke oplosmiddelen worden gebruikt bij IR-spectroscopie?
Welke oplosmiddelen worden gebruikt bij IR-spectroscopie?  Waarom worden ionen bij elkaar gehouden in een ionische binding?
Waarom worden ionen bij elkaar gehouden in een ionische binding?  Nieuwe materialen helpen volumetrisch 3D-printen uit te breiden
Nieuwe materialen helpen volumetrisch 3D-printen uit te breiden Modellen worden gebruikt om te laten zien welke eigenschappen van een verbinding en chemische structuur?
Modellen worden gebruikt om te laten zien welke eigenschappen van een verbinding en chemische structuur?  Ik wil een eenvoudig antwoord voor waarom drijft ijs in water?
Ik wil een eenvoudig antwoord voor waarom drijft ijs in water?
 Goederen die te mooi zijn om te gebruiken, kunnen een groot effect hebben op duurzaamheid
Goederen die te mooi zijn om te gebruiken, kunnen een groot effect hebben op duurzaamheid Slow slips bieden inzicht in aardbevingen
Slow slips bieden inzicht in aardbevingen EPA-adviseur promoot schadelijke ideeën, wetenschappers zeggen:
EPA-adviseur promoot schadelijke ideeën, wetenschappers zeggen: Een schot van hoop in het licht van klimaatwanhoop
Een schot van hoop in het licht van klimaatwanhoop Zure kustzeeën voor de VS brengen veelvoorkomende vissoorten in gevaar
Zure kustzeeën voor de VS brengen veelvoorkomende vissoorten in gevaar
Hoofdlijnen
- Wat zijn de speciale dingen die gebeuren wanneer cellen worden gesplitst?
- Deze reuzen zijn de zeven hoogste bomen ter wereld
- Wat is de eenheid van natuurlijke selectie?
- Xist- en lapjeskatten:hoe extra genen op X-chromosomen worden uitgeschakeld
- Waarom worden vliegen geboren?
- Hoe de hoektanden van vleesetende zoogdieren zich ontwikkelden tot supermoordenaars
- Wat is een gras? Chloroplast-DNA laat zien dat gras dat misschien niet is
- Onderzoek verklaart waarom hennep en marihuana verschillend zijn
- Welk instrument wordt gebruikt om een minuut organisme te bekijken?
- Niet-vluchtig geheugen zo snel als RAM met de capaciteit van flash
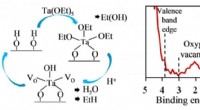
- Warmteopslag:wetenschappers ontwikkelen materiaal dat stabiel, efficiënt en milieuvriendelijk is

- De zwaarste stoffen van de natuur gedecodeerd

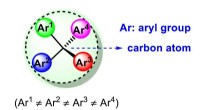
- Wetenschappers hebben nieuwe manier gevonden om chirale tetraarylmethaan te synthetiseren
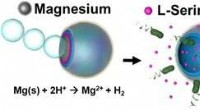
- Zelfrijdend, ui-achtige microvoertuigen kunnen aantrekken, val, en biologische bedreigingen te vernietigen
 De oorsprong van genen voor het maken van bloemen
De oorsprong van genen voor het maken van bloemen Is een charterschool de juiste keuze voor uw kind?
Is een charterschool de juiste keuze voor uw kind? Welke planeten hebben grotere orbitale stralen terrestrische gasreuzen?
Welke planeten hebben grotere orbitale stralen terrestrische gasreuzen?  Hittegolven van het Noordpoolgebied tot Japan:een teken dat er dingen komen?
Hittegolven van het Noordpoolgebied tot Japan:een teken dat er dingen komen?  Waarom crashte NASA een object in de maan?
Waarom crashte NASA een object in de maan?  Wolkencamera Gemini Observatory legt dramatische gloed van vulkanen vast
Wolkencamera Gemini Observatory legt dramatische gloed van vulkanen vast Op welke plaatgrens vond de vulkaan eyjafjallajokull plaats?
Op welke plaatgrens vond de vulkaan eyjafjallajokull plaats?  Onderzoekers vinden potentieel gebruik voor gerecycled plastic in beton
Onderzoekers vinden potentieel gebruik voor gerecycled plastic in beton
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

