
Wetenschap
Hoeveel stikstofmoleculen zijn opgenomen in 1,00 L gas bij ATM en 298 K Hoe atomen?
1. Gebruik de ideale gaswet:
De ideale gaswet stelt:PV =NRT
Waar:
* P =druk (atm)
* V =volume (l)
* n =aantal mol
* R =ideale gasconstante (0,0821 l · atm/mol · k)
* T =temperatuur (k)
2. Oplossen voor het aantal mol (n):
* n =pv / rt
* n =(1 atm * 1,00 l) / (0.0821 l · atm / mol · k * 298 k)
* n ≈ 0,0409 mol
3. Converteer mol naar moleculen:
* Het nummer van Avogadro vertelt ons dat 1 mol 6.022 x 10²³ moleculen bevat.
* Aantal moleculen =n * Avogadro's nummer
* Aantal moleculen ≈ 0,0409 mol * 6.022 x 10²³ Moleculen/mol
* Aantal moleculen ≈ 2,46 x 10²² moleculen
Daarom zijn er ongeveer 2,46 x 10²² stikstofmoleculen in 1,00 L gas bij 1 atm en 298 K.
 Natuurkundigen werpen röntgenlicht op smeltende polymeren
Natuurkundigen werpen röntgenlicht op smeltende polymeren Vervalste arganolie ontdekt door nieuwe analytische methode
Vervalste arganolie ontdekt door nieuwe analytische methode Wat vertelt de temperatuur ons over de deeltjes van een stof?
Wat vertelt de temperatuur ons over de deeltjes van een stof?  Een kamerperimeter berekenen
Een kamerperimeter berekenen Waarom we op zoek zijn naar chemicaliën in de zeebodem om de klimaatverandering te helpen voorspellen
Waarom we op zoek zijn naar chemicaliën in de zeebodem om de klimaatverandering te helpen voorspellen
 Rapport zegt niet te laat om een 3C warmere wereld te vermijden
Rapport zegt niet te laat om een 3C warmere wereld te vermijden Wetenschappers zeggen dat de kosten van het afvangen van CO2 afnemen
Wetenschappers zeggen dat de kosten van het afvangen van CO2 afnemen Waarom betrof de studie van de aardewetenschap veel verschillende wetenschappen?
Waarom betrof de studie van de aardewetenschap veel verschillende wetenschappen?  Heropbouw van bodemmicrobiomen in landbouwsystemen met hoge tunnels, focus van onderzoek
Heropbouw van bodemmicrobiomen in landbouwsystemen met hoge tunnels, focus van onderzoek Satelliet ziet oog van Supertyfoon Yutus over Tinian . gaan
Satelliet ziet oog van Supertyfoon Yutus over Tinian . gaan
Hoofdlijnen
- Welk product maakt voedselproductie efficiënter?
- Hoe verhoudt een dierencel zich tot een bijenkorf?
- Wat maakt bodem, bodem? Onderzoekers vinden verborgen aanwijzingen in DNA
- Waar verschijnt PGAL in cellulaire ademhaling?
- Drie nieuwe soorten grondslangen ontdekt onder kerkhoven en kerken in Ecuador
- Zijn de lipiden in het celmembraan gerangschikt?
- Grazende paarden op betere weiden
- Wat vormen wetenschapper voordat ze een hypothese vormen?
- Onderzoekers voltooien de mitochondriale genoomanalyse van de bedreigde plant Primulina hunanensis
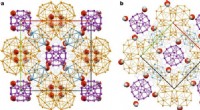
- Twee Frank-Kasper-fasen in zoutkristalstructuren waargenomen
- Nylon 6-6 groener maken, en zonder zink

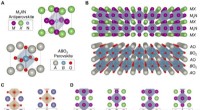
- Epitaxiale antiperovskiet/perovskiet heterostructuren voor materiaalontwerp
- Nieuwe hydrogels verdorren terwijl stamcellen bloeien voor weefselherstel

- Transparant keramisch pantser biedt superieure ballistische bescherming ten opzichte van traditionele glaslaminaten

 Als een krat stationair is op een helling, betekent dit dan dat in de staat van evenwicht?
Als een krat stationair is op een helling, betekent dit dan dat in de staat van evenwicht?  Mysterieuze oude grafheuvel gebruikt voor 2, 000 jaar
Mysterieuze oude grafheuvel gebruikt voor 2, 000 jaar Math Icebreaker Games
Math Icebreaker Games  Hoe de sterke kracht de zwaartekrachtgolfachtergrond beïnvloedt
Hoe de sterke kracht de zwaartekrachtgolfachtergrond beïnvloedt  Agressief? Homofoob? Stoïcijns? Dit is wat duizenden Australische mannen ons vertelden over moderne mannelijkheid
Agressief? Homofoob? Stoïcijns? Dit is wat duizenden Australische mannen ons vertelden over moderne mannelijkheid  Videosterren:Russische kinderbloggers scoren miljoenen likes
Videosterren:Russische kinderbloggers scoren miljoenen likes Hoeveel mensen op Pearys Expedition bereikten de Noordpool?
Hoeveel mensen op Pearys Expedition bereikten de Noordpool?  Hoe ver gaat een kogel in de lucht?
Hoe ver gaat een kogel in de lucht?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

