
Wetenschap
Waarom smelt ijs wanneer zout wordt toegevoegd?
1. De depressie van het vriespunt:
* Puur water bevriest bij 0 ° C (32 ° F). Dit komt omdat de watermoleculen zich in een kristallijne structuur rangschikken.
* Zout (NaCl) lost op in water en breekt af in natrium (Na+) en chloride (Cl-) ionen. Deze ionen verstoren de geordende opstelling van watermoleculen, waardoor het voor hen moeilijker is om te bevriezen.
* Deze verstoring verlaagt het vriespunt van het water. Hoe meer zout je toevoegt, hoe lager het vriespunt wordt.
2. Hoe zout ijs smelt:
* Wanneer zout wordt toegevoegd aan ijs, begint het op te lossen in de dunne laag water die altijd op het ijsoppervlak bestaat.
* Dit oplossingsproces absorbeert warmte uit de omgeving, inclusief het ijs zelf. Deze absorptie van warmte verhoogt de temperatuur van het ijs en smelt het.
* Het zout lost vervolgens op in het gesmolten water, waardoor het vriespunt verder wordt verlaagd. Dit betekent dat het omringende ijs nog kouder moet zijn om opnieuw te bevriezen.
3. Waarom het beter werkt op ijs:
* zout werkt het beste op ijs omdat het ijs al een kleine hoeveelheid water heeft. Hierdoor kan het zout gemakkelijk oplossen.
* Zout smelt het ijs niet op zichzelf. Het verlaagt eenvoudig het vriespunt, waardoor het ijs bij een lagere temperatuur kan smelten dan normaal.
Belangrijke opmerking: Hoewel zout effectief is in het smelten van ijs, kan het ook schadelijk zijn voor het milieu. Overmatig gebruik kan wegen, waterwegen en vegetatie beschadigen.
 Waarom verandert kopersulfaat massa wanneer verwarmd?
Waarom verandert kopersulfaat massa wanneer verwarmd?  Welke textuur is stollingsgesteente?
Welke textuur is stollingsgesteente?  Wat is de evenwichtige chemische vergelijking voor ontleding van kaliumchloraat V?
Wat is de evenwichtige chemische vergelijking voor ontleding van kaliumchloraat V?  Wat gebeurt er als de scheurde limoen reageert met chloor?
Wat gebeurt er als de scheurde limoen reageert met chloor?  Op weg naar een ziektesnuivend apparaat dat wedijvert met de neus van een hond
Op weg naar een ziektesnuivend apparaat dat wedijvert met de neus van een hond
 2.229 miljard jaar:wetenschappers dateren de oudste meteoorkrater ter wereld
2.229 miljard jaar:wetenschappers dateren de oudste meteoorkrater ter wereld Wat is het oppervlak van het oppervlak en de onmiddellijke atmosfeer die het leven ondersteunt?
Wat is het oppervlak van het oppervlak en de onmiddellijke atmosfeer die het leven ondersteunt?  Is vleesvrij eten het antwoord op klimaatverandering?
Is vleesvrij eten het antwoord op klimaatverandering? Boeren in Vietnam strijden om zoet water, omdat droogte verzilting met zich meebrengt
Boeren in Vietnam strijden om zoet water, omdat droogte verzilting met zich meebrengt  Amazone rivier niet jonger dan 9 miljoen jaar, nieuwe studie toont
Amazone rivier niet jonger dan 9 miljoen jaar, nieuwe studie toont
Hoofdlijnen
- Lichtgroene planten besparen stikstof zonder in te boeten aan fotosynthetische efficiëntie
- Wie is de vaderbiologie?
- Waarom hebben wetenschappers moeite met het opnemen van virussen in de catogorie van levende organisaties?
- Heeft Charles Darwin de beagle bezit?
- Hoe produceren twee heterozygote organismen op nakomelingen met een recessief fenotype?
- Waarom zoveel dieren, inclusief onze huisdieren, een derde ooglid hebben, maar mensen niet
- Wat richt zich alleen aan de wetenschap?
- Hoe heeft de wetenschap zijn naam gekregen?
- Hoe een vormveranderende receptor de celgroei beïnvloedt
- Baanbrekende chemiebenadering kan leiden tot robuustere zachte elektronica

- Nieuwe meettechniek kan pulpfabrieken miljoenen besparen

- Nieuwe zouten leggen de lat hoger voor lithium-ionbatterijtechnologie

- Onderzoekers lossen op hoe schimmels verbindingen produceren met potentiële farmaceutische toepassingen
- Nieuw wereldrecord in materiaalonderzoek:röntgenmicroscopie met een snelheid van 1000 tomogrammen per seconde
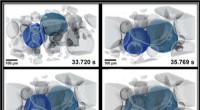
 Een nieuw meetrecord voor het sterkste magnetische veld in het universum
Een nieuw meetrecord voor het sterkste magnetische veld in het universum Heeft Neutron Star een evenementhorizon?
Heeft Neutron Star een evenementhorizon?  Wat is de overdracht van thermische energie door verwarmde beweging?
Wat is de overdracht van thermische energie door verwarmde beweging?  Magnetische bacteriën als micropompen
Magnetische bacteriën als micropompen De betekenis en betekenis van het engelnummer 1212
De betekenis en betekenis van het engelnummer 1212  Opwarming van de aarde verhoogt het risico op aardverschuivingstsunami's:studie
Opwarming van de aarde verhoogt het risico op aardverschuivingstsunami's:studie Hoe lagers werken
Hoe lagers werken  Welke groep organismen omvat alleen meercellige heterotrofen?
Welke groep organismen omvat alleen meercellige heterotrofen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

