
Wetenschap
Welke stof verandert de snelheid van een chemische reactie zonder zichzelf te veranderen?
Hier is een uitsplitsing:
* katalysator: Een stof die een chemische reactie versnelt zonder tijdens het proces te worden geconsumeerd. Het biedt een alternatieve route voor de reactie met een lagere activeringsenergie.
* Activeringsenergie: De minimale energie die nodig is om een reactie te laten optreden.
Hoe katalysatoren werken:
Katalysatoren werken door een alternatieve reactieroute te bieden met een lagere activeringsenergie. Dit betekent dat meer moleculen voldoende energie hebben om te reageren, wat leidt tot een snellere reactiesnelheid.
Voorbeelden van katalysatoren:
* enzymen: Biologische katalysatoren die biochemische reacties in levende organismen vergemakkelijken.
* metalen: Metalen zoals platina en palladium worden gebruikt als katalysatoren in verschillende industriële processen.
* zuren: Zuren zoals zwavelzuur kunnen in sommige reacties als katalysatoren werken.
Sleutelpunt: Katalysatoren veranderen de evenwichtspositie van een reactie niet; Ze versnellen alleen de snelheid waarmee evenwicht wordt bereikt.
 Wanneer zou een gas worden omschreven als damp?
Wanneer zou een gas worden omschreven als damp?  Wat is het aantal atomen in de FCC-eenheidscel?
Wat is het aantal atomen in de FCC-eenheidscel?  Natrium zal reageren met zuurstof om natriumoxide te vormen. Gebruik de onderstaande formule bepalen hoeveel gram oxide wordt gevormd als 46 worden gebruikt in reactie.?
Natrium zal reageren met zuurstof om natriumoxide te vormen. Gebruik de onderstaande formule bepalen hoeveel gram oxide wordt gevormd als 46 worden gebruikt in reactie.?  Overgangsmetaalvrij bariumhydride medieert distikstoffixatie en ammoniaksynthese
Overgangsmetaalvrij bariumhydride medieert distikstoffixatie en ammoniaksynthese Zuurstofbleken versus Chloor Bleach
Zuurstofbleken versus Chloor Bleach
Hoofdlijnen
- Wat is er tussen cellen?
- Gerstplanten verfijnen hun wortelmicrobiële gemeenschappen door middel van suikerachtige afscheidingen
- Zeevruchten met een ecolabel zijn niet altijd wat het lijkt
- Wat betekent cardiobiologie?
- Kan een vleermuis van de ene soort pro-creëren met een andere soort?
- Hoe polyfasische slaap werkt
- Hoe zijn bacteriën betrokken bij de vorming van steenkool?
- Welke transcriptiefactor is hoogstwaarschijnlijk wanneer ze naar beneden gereguleerd worden om oligodendrocieten te veroorzaken die zich niet correct vormen?
- Wat bevat GEEN structureel eiwit?
- Nieuwe geconsolideerde bio-saccharificatietechniek voor lignocelluloseconversie ontwikkeld
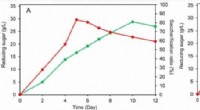
- Team vervaardigt magneten volledig van zeldzame aardmetalen uit de VS

- Doorbraak kan organische elektronica lanceren buiten de schermen van mobiele telefoons

- Wondgenezende biomaterialen activeren het immuunsysteem voor een sterkere huid
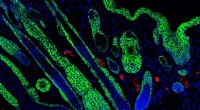
- Een nieuwe rekbare batterij kan draagbare elektronica van stroom voorzien

 Voor klimrobots, alles is mogelijk
Voor klimrobots, alles is mogelijk Wat is het aantal elementen natriumbicarbonaat?
Wat is het aantal elementen natriumbicarbonaat?  Hoe werd een eeuwenoude plant uit Latijns-Amerika het op een na belangrijkste marktgewas van Azië?
Hoe werd een eeuwenoude plant uit Latijns-Amerika het op een na belangrijkste marktgewas van Azië?  Onderzoekers helpen de kloof tussen psychologie en gamification te overbruggen
Onderzoekers helpen de kloof tussen psychologie en gamification te overbruggen Zwaartekrachtgolven opnieuw gedetecteerd,
Zwaartekrachtgolven opnieuw gedetecteerd,  Kunnen metalen positieve en negatieve oxidatiegetallen hebben?
Kunnen metalen positieve en negatieve oxidatiegetallen hebben?  Is de lucht en de ruimte hetzelfde?
Is de lucht en de ruimte hetzelfde?  De kinetische energie berekenen in joules van een auto van 1500 kg die op 29ms beweegt?
De kinetische energie berekenen in joules van een auto van 1500 kg die op 29ms beweegt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

