
Wetenschap
Wat is meer polaire silicium tetra bromide of waterstofcyanide?
polariteit is een maat voor de ongelijke verdeling van elektronendichtheid in een molecuul. Het komt voort uit verschillen in elektronegativiteit tussen atomen.
Elektronegativiteit is het vermogen van een atoom om elektronen naar zichzelf aan te trekken in een chemische binding.
waterstofcyanide (HCN)
* Polaire covalente binding: De koolstof-nitrogene binding in HCN is een polaire covalente binding omdat stikstof meer elektronegatief is dan koolstof. Dit creëert een gedeeltelijke negatieve lading op het stikstofatoom en een gedeeltelijke positieve lading op het koolstofatoom.
* lineaire geometrie: De lineaire geometrie van HCN zorgt voor een netto dipoolmoment, omdat de obligatie -dipolen elkaar niet annuleren.
siliciumtetrabromide (Sibr₄)
* Polaire covalente bindingen: De siliciumbroombindingen in Sibr₄ zijn ook polaire covalente bindingen, waarbij broom elektronegatiefer is dan silicium.
* Tetraëdrische geometrie: De tetraëdrische geometrie van SIBR₄ resulteert echter in de binddipolen die elkaar annuleren, wat resulteert in een niet -polair molecuul.
Conclusie:
Vanwege zijn polaire covalente bindingen en lineaire geometrie heeft waterstofcyanide (HCN) een groter dipoolmoment en is daarom meer polair dan siliciumtetrabromide (SIBR₄).
 Is koolstofmetaal niet -metaal of metalloïde?
Is koolstofmetaal niet -metaal of metalloïde?  Welke elementen zijn in C10H16O3N2S?
Welke elementen zijn in C10H16O3N2S?  Nieuwe manier om taaie koolstofbindingen te splitsen kan deuren openen voor groenere chemicaliën
Nieuwe manier om taaie koolstofbindingen te splitsen kan deuren openen voor groenere chemicaliën Hoe maak je lijmen voor elektronica, voertuigen, en moeilijker bouwen?
Hoe maak je lijmen voor elektronica, voertuigen, en moeilijker bouwen? Als de atomaire massa van een koolstof 12 1 mol pure is, zal van?
Als de atomaire massa van een koolstof 12 1 mol pure is, zal van?
Hoofdlijnen
- Welk molecuul bindt aan de startreactie van de receptor in cel?
- Heeft u een interne dialoog? Niet iedereen doet dat
- Hoe verkrijgen pelecypods voedsel?
- Organismen wiens cellen geen zichtbare kern hebben?
- Is een amoeba beweeglijk of sessiel?
- Worden recessieve eigenschappen altijd getoond in een nakomelingen?
- Het nepnieuwsprobleem van Facebook:wat is de verantwoordelijkheid ervan?
- Welke groep is nauw verwant aan archabacteriën?
- Onderzoek toont effecten aan van hogere herfsttemperaturen op insecten
- Wetenschappers stellen een nieuwe strategie voor om het celcommunicatienetwerk te reguleren

- Op gallium gebaseerd oplosmiddel analyseert efficiënt optisch actieve alcoholen
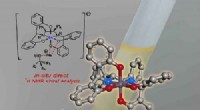
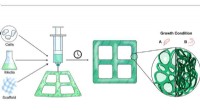
- Naar aanpasbaar hout, gekweekt in een laboratorium
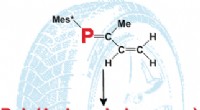
- Een chemisch functionele fosforversie van natuurlijk rubber
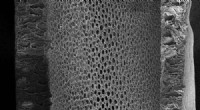
- Membranen voor het op industriële schaal scheiden van chemische mengsels
 "How Do Limes Reproduce?
"How Do Limes Reproduce? Kleine carnivoren zijn misschien wel het meest destructief
Kleine carnivoren zijn misschien wel het meest destructief Twee factoren die invloed hebben op de zwaartekracht van een object
Twee factoren die invloed hebben op de zwaartekracht van een object  Wat een kleine massa met veel kracht uitgeoefend?
Wat een kleine massa met veel kracht uitgeoefend?  Hoe te omzetten Watt-uren per meter Geregeld naar Lux-uren
Hoe te omzetten Watt-uren per meter Geregeld naar Lux-uren Hoeveel is 2,5 kg in lbs en ounces?
Hoeveel is 2,5 kg in lbs en ounces?  Welke planeet in uw zonnestelsel heeft de grootste dichtheid?
Welke planeet in uw zonnestelsel heeft de grootste dichtheid?  Kunnen we de vernietiging van donkere materie binnen bolvormige sterrenhopen detecteren?
Kunnen we de vernietiging van donkere materie binnen bolvormige sterrenhopen detecteren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

