
Wetenschap
Welk edelgas heeft dezelfde elektronenconfiguratie van de grondtoestand als chloor in thionylchloride?
1. Lewis -structuur van thionylchloride (SOCL₂):
* zwavel (s): 6 valentie -elektronen
* zuurstof (O): 6 valentie -elektronen
* chloor (CL): 7 valentie -elektronen (x2)
De Lewis -structuur laat zien dat zwavel een dubbele binding vormt met zuurstof en een enkele binding met elk chlooratoom.
2. Bepaal de elektronenconfiguratie van chloor:
* Chloor's grondtoestand elektronenconfiguratie: 1S² 2S² 2P⁶ 3S² 3P⁵
* chloor in Socl₂: Elk chlooratoom krijgt één elektron van de binding met zwavel, waardoor ze een volledig octet krijgen. Dit betekent dat hun elektronenconfiguratie 1S² 2S² 2P⁶ 3S² 3P⁶ wordt.
3. Identificeer het edelgas:
* argon (AR): heeft de elektronenconfiguratie 1S² 2S² 2P⁶ 3S² 3P⁶
Daarom heeft Argon (AR) dezelfde grondtoestand elektronenconfiguratie als chloor in thionylchloride.
 Hoe lijken twee isotopen van een element op elkaar?
Hoe lijken twee isotopen van een element op elkaar?  Nieuwe geconsolideerde bio-saccharificatietechniek voor lignocelluloseconversie ontwikkeld
Nieuwe geconsolideerde bio-saccharificatietechniek voor lignocelluloseconversie ontwikkeld Wat gebeurt er met de snelheidsconstante van een chemische reactie als de temperatuur stijgt?
Wat gebeurt er met de snelheidsconstante van een chemische reactie als de temperatuur stijgt?  Begrijpen hoe de monomeersequentie de geleiding in 'moleculaire draden' beïnvloedt
Begrijpen hoe de monomeersequentie de geleiding in 'moleculaire draden' beïnvloedt  Nieuwe sensor detecteert chemicaliën die de schildklier aantasten
Nieuwe sensor detecteert chemicaliën die de schildklier aantasten
Hoofdlijnen
- Hoe evolueert de mens?
- Hoe weet je of er iets wordt bestuurd in de wetenschap?
- Nieuwe 3D-visualisatietool kan gerichte medicijnafgifte voor cystische fibrose en andere aandoeningen mogelijk maken
- Een organisme dat geen eigen voedsel kan maken, wordt A- genoemd?
- Hoe elektroconvulsietherapie werkt
- Het type celverbinding dat de inhoud voorkomt maag of urineblaas om in omliggende weefsels te lekken?
- Welke soorten eiwitten worden gemaakt door synthese?
- Waarom worden sommige gecontroleerd door multiple allelen of genen?
- Roze + roze =goud? De veren van hybride kolibries komen niet overeen met die van zijn ouders
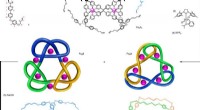
- Onderzoekers creëren de meest verwarde, in elkaar grijpende molecule ooit
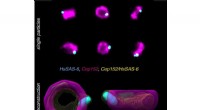
- Superresolutiemicroscopie bouwt multicolor 3D van 2D
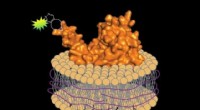
- Een robot en software maken het eenvoudiger om geavanceerde materialen te maken

- Onderzoekers verkrijgen nieuwe resultaten over diëlektrische recombinatie-precisiespectroscopie

- Een platform om fluorescent gelabelde eiwitten te bereiden en hun natuurlijke omgeving te simuleren
 Chinese wetenschappers onthullen een nieuwe signaalroute voor koude tolerantie in rijst
Chinese wetenschappers onthullen een nieuwe signaalroute voor koude tolerantie in rijst Hoe is de wetenschap belangrijk in carrières zonder wetenschap?
Hoe is de wetenschap belangrijk in carrières zonder wetenschap?  Hoe wordt energie uitgevoerd via een vast object?
Hoe wordt energie uitgevoerd via een vast object?  Ontdekking van nieuwe mechanismen om de stroom van geluid te regelen
Ontdekking van nieuwe mechanismen om de stroom van geluid te regelen Fluorescerende nanobuiscoating kan spanning detecteren
Fluorescerende nanobuiscoating kan spanning detecteren Onderzoekers ontwikkelen een nieuwe biologisch afbreekbare nanosonde om diabetische retinopathie in een vroeg stadium te detecteren
Onderzoekers ontwikkelen een nieuwe biologisch afbreekbare nanosonde om diabetische retinopathie in een vroeg stadium te detecteren  De Tijuana-rivier is een van de meest bedreigde rivieren in Amerika als gevolg van een rioolcrisis
De Tijuana-rivier is een van de meest bedreigde rivieren in Amerika als gevolg van een rioolcrisis  Is papier een mengsel of verbinding?
Is papier een mengsel of verbinding?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

