
Wetenschap
Een platform om fluorescent gelabelde eiwitten te bereiden en hun natuurlijke omgeving te simuleren
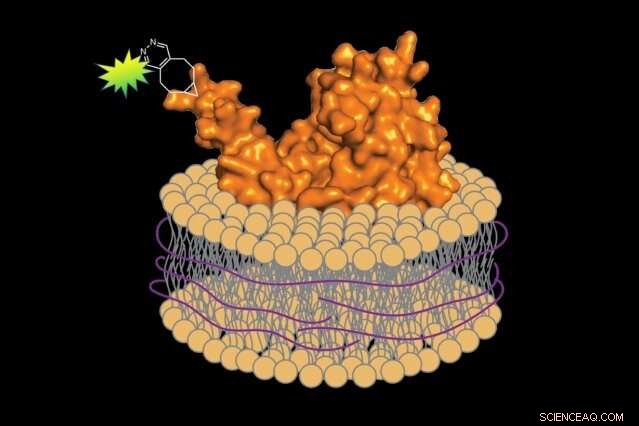
Met behulp van een wasmiddelvrije methode, biologen kunnen fluorescent gelabelde eiwitten bereiden samen met een klein segment van het bijbehorende celmembraan, behoud van de natuurlijke omgeving van het eiwit. Krediet:Jean-Marie Swiecicki
Alle cellen hebben een lipidemembraan dat hun interne componenten omringt en een beschermende barrière vormt om te controleren wat er binnenkomt en wat eruit blijft. De eiwitten die in deze membranen zijn ingebed zijn essentieel voor het leven; ze helpen het transport van voedingsstoffen te vergemakkelijken, energieomzetting en -opslag, en cellulaire communicatie. Ze zijn ook belangrijk bij ziekten bij de mens, en vertegenwoordigen ongeveer 60 procent van de goedgekeurde medicijndoelen. Om deze membraaneiwitten buiten de complexiteit van de cel te bestuderen, onderzoekers moeten wasmiddel gebruiken om het membraan weg te halen en te extraheren. Echter, het bepalen van het beste wasmiddel voor elk eiwit kan uitgebreid vallen en opstaan. En, het verwijderen van een eiwit uit zijn natuurlijke omgeving dreigt de gevouwen structuur te destabiliseren en de functie te verstoren.
In een studie gepubliceerd op 9 december in Cel Chemische Biologie , wetenschappers van MIT bedachten een snelle en generaliseerbare manier om te extraheren, zuiveren, en label membraaneiwitten voor beeldvorming zonder enig detergens - een deel van het omringende membraan meenemen om het eiwit te beschermen en zijn natuurlijke omgeving te simuleren. Hun aanpak combineert gevestigde chemische en biochemische technieken op een nieuwe manier, efficiënt isoleren van het eiwit zodat het fluorescerend kan worden gelabeld en onder een microscoop kan worden onderzocht.
"Ik grap altijd dat het niet erg levensecht is om eiwitten in zeep te bestuderen, " zegt senior auteur Barbara Imperiali, hoogleraar biologie en scheikunde. "We hebben een workflow gecreëerd waarmee membraaneiwitten in beeld kunnen worden gebracht met behoud van hun oorspronkelijke identiteit en interacties. Hopelijk zullen nu minder mensen terugdeinzen voor het bestuderen van membraaneiwitten, gezien hun belang in veel fysiologische processen."
Als lid van het Imperiali-lab, voormalig postdoc en hoofdauteur Jean-Marie Swiecicki onderzocht membraaneiwitten van de voedselpathogeen Campylobacter jejuni. In dit onderzoek, Swiecicki richtte zich op PglC en PglA, twee membraaneiwitten die een rol spelen bij het infecteren van menselijke cellen door de bacteriën. Zijn experimenten vereisten het labelen van PglC en PglA met fluorescerende tags om ze te kunnen volgen. Echter, hij was niet tevreden met de bestaande methoden om dit te doen.
In sommige gevallen, de fluorescerende tags die in het eiwit moeten worden opgenomen om het zichtbaar te maken, zijn te groot om op gedefinieerde posities te worden geplaatst. In andere gevallen, deze tags schijnen niet helder genoeg, of interfereren met de structuur en functie van het eiwit.
Om dergelijke problemen te voorkomen, Swiecicki besloot een methode te gebruiken die bekend staat als 'mutagenese van onnatuurlijke aminozuren'. Aminozuren zijn de eenheden waaruit het eiwit bestaat, en onnatuurlijke aminozuurmutagenese omvat het toevoegen van een nieuw aminozuur dat een gemanipuleerde chemische groep bevat binnen de eiwitsequentie. Deze chemische groep kan dan worden gelabeld met een fel gloeiend label.
Swiecicki plaatste de genetische code voor de C. jejuni membraaneiwitten in een andere bacterie, Escherichia coli. Binnen E. coli, hij zou het onnatuurlijke aminozuur kunnen opnemen, die chemisch zou kunnen worden gewijzigd om het fluorescerende label toe te voegen.
Toen het tijd was om de eiwitten van het membraan te verwijderen, hij verving het wasmiddel door een andere stof:een polymeer van styreen-maleïnezuur (SMA). In tegenstelling tot wasmiddel, SMA wikkelt het geëxtraheerde eiwit en een klein segment van het bijbehorende membraan in een beschermend omhulsel, behoud van zijn oorspronkelijke omgeving. Imperiali legt uit, "Het is als een sjaal die je nek beschermt tegen de kou."
Swiecicki kon vervolgens de gloeiende eiwitten onder een microscoop volgen om te verifiëren dat zijn techniek selectief genoeg was om individuele membraaneiwitten te isoleren. Het hele proces, hij zegt, duurt maar een paar dagen, en is over het algemeen veel sneller en betrouwbaarder dan extractiemethoden op basis van detergenten, die maanden kunnen duren en de expertise van hoogopgeleide biochemici vereisen om te optimaliseren.
"Ik zou niet zeggen dat het een wondermiddel is dat voor elk eiwit gaat werken, " zegt hij. "Maar het is een zeer efficiënt hulpmiddel dat het gemakkelijker zou kunnen maken om veel verschillende soorten membraaneiwitten te bestuderen." hij zegt, het kan zelfs helpen bij het vergemakkelijken van medicijnschermen met een hoge doorvoer.
"Als iemand die werkt aan membraaneiwitcomplexen, Ik kan getuigen van de grote behoefte aan betere methoden om ze te bestuderen, " zegt Suzanne Walker, een professor in de microbiologie aan de Harvard Medical School die niet betrokken was bij het onderzoek. Ze hoopt de in het artikel geschetste aanpak uit te breiden naar de eiwitcomplexen die ze in haar eigen lab onderzoekt. "Ik waardeerde de uitgebreide details in de tekst over het succesvol toepassen van de strategie, " zij voegt toe.
De volgende stappen zijn het testen van de techniek op zoogdiereiwitten, en het isoleren van meerdere eiwitten tegelijk in de SMA-schaal om hun interacties te observeren. En, natuurlijk, elke nieuwe techniek verdient een naam. "We werken nog steeds aan een pakkend acroniem, ' zegt Imperiali. 'Enig idee?'
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Polymeer dat geneest als een huid, zeer dicht bij productie op industriële schaal
Polymeer dat geneest als een huid, zeer dicht bij productie op industriële schaal Nieuw licht werpen op intensief bestudeerd materiaal
Nieuw licht werpen op intensief bestudeerd materiaal Hoe langzamer ze draaien, hoe helderder ze gloeien
Hoe langzamer ze draaien, hoe helderder ze gloeien Elastische incoherente neutronenverstrooiing bij ILL daagt het Lindemann-criterium in eiwitten uit
Elastische incoherente neutronenverstrooiing bij ILL daagt het Lindemann-criterium in eiwitten uit Huidkankermysterie onthuld in yin- en yang-eiwit
Huidkankermysterie onthuld in yin- en yang-eiwit
 El Niño heeft invloed op de neerslagrecyclingverhouding over het Tibetaanse plateau op een tijdschaal van meerdere jaren
El Niño heeft invloed op de neerslagrecyclingverhouding over het Tibetaanse plateau op een tijdschaal van meerdere jaren Invasieve koraalsoorten hebben een verbazingwekkende capaciteit voor regeneratie
Invasieve koraalsoorten hebben een verbazingwekkende capaciteit voor regeneratie Welk type vegetatie is te vinden in koraalriffen?
Welk type vegetatie is te vinden in koraalriffen?  natte winter, lente verlichten droogte in staat
natte winter, lente verlichten droogte in staat Mensen, stroomkosten houden indoor farming laag
Mensen, stroomkosten houden indoor farming laag
Hoofdlijnen
- Relatie tussen celstructuur en functie
- Wat zijn wierook en mirre?
- Stijgende CO2 zorgt ook voor overlast in zoetwater, studie suggereert:
- De allereerste tagging van Amazone-dolfijnen om de inspanningen voor natuurbehoud te stimuleren
- Hoe groeit schimmel op brood?
- Je wandeling is zo duidelijk dat het diepe persoonlijkheidskenmerken kan onthullen
- Biochemistry Blotting Techniques
- Wat maakt een allel dominant, recessief of mede-dominant?
- Wat is een kruisverwijzingssysteem?
- Video:Kunnen we oceaanwater drinkbaar maken – en zouden we dat ook moeten doen?

- Krachtige lasers voor kwetsbare kunstwerken

- Levensbouwstenen waargenomen in een ruimteachtige omgeving
- De genen vinden om een betere kankerbehandeling op te bouwen

- Door schimmels geproduceerd pigment is veelbelovend als halfgeleidermateriaal

 Onderzoek naar kankerverwekkende nanodeeltjes warmt op
Onderzoek naar kankerverwekkende nanodeeltjes warmt op Onderzoekers 3D-print prototype voor bionisch oog
Onderzoekers 3D-print prototype voor bionisch oog Plasticvervuiling verhoogt de druk op de onrustige schildpadden in Myanmar
Plasticvervuiling verhoogt de druk op de onrustige schildpadden in Myanmar Nieuwe techniek om supersponzen te maken is een game changer
Nieuwe techniek om supersponzen te maken is een game changer NASA simuleert asteroïde-inslagen om mogelijke levensbedreigende gebeurtenissen te helpen identificeren
NASA simuleert asteroïde-inslagen om mogelijke levensbedreigende gebeurtenissen te helpen identificeren Sekstechnologie wil boven negatief imago uitstijgen
Sekstechnologie wil boven negatief imago uitstijgen NASA ziet Debby overgaan in een tropische storm
NASA ziet Debby overgaan in een tropische storm 'S Werelds meest stinkende fruit kan je mobiele telefoon opladen
'S Werelds meest stinkende fruit kan je mobiele telefoon opladen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Norway | French | Danish |

-
Wetenschap © https://nl.scienceaq.com

