
Wetenschap
Wat is een covalent oxide?
Hier is een uitsplitsing:
Key -functies:
* Niet-metalen binding: Covalente oxiden worden gevormd tussen zuurstof en een niet-metaal element. Voorbeelden van niet-metalen zijn koolstof, stikstof, fosfor, zwavel, chloor en broom.
* Covalente binding: De binding tussen de zuurstof en het niet-metaal is een covalente binding, wat betekent dat elektronen worden gedeeld tussen de atomen.
* Moleculaire structuur: Covalente oxiden bestaan meestal als afzonderlijke moleculen met goed gedefinieerde structuren.
* gevarieerde eigenschappen: De eigenschappen van covalente oxiden kunnen variëren afhankelijk van het betrokken niet-metaal. Enkele voorbeelden zijn:
* koolstofdioxide (CO2): Een kleurloos gas bij kamertemperatuur.
* zwaveldioxide (SO2): Een scherp gas met een verstikkende geur.
* stikstofdioxide (NO2): Een giftig roodbruine gas.
* Water (H2O): Een vloeistof bij kamertemperatuur.
Voorbeelden:
* CO2 (koolstofdioxide)
* SO2 (zwaveldioxide)
* NO2 (stikstofdioxide)
* N2O (stikstofoxide)
* P2O5 (fosfor pentoxide)
Contrast met ionische oxiden:
Ionische oxiden worden daarentegen gevormd tussen zuurstof en een metaalelement. Ze worden gevormd door de overdracht van elektronen, wat leidt tot ionische bindingen.
Belang:
Covalente oxiden spelen een belangrijke rol op verschillende gebieden:
* Milieuchemie: Ze zijn betrokken bij atmosferische processen zoals zure regen en klimaatverandering.
* Industriële chemie: Ze worden gebruikt in verschillende industriële processen, zoals de productie van zwavelzuur en salpeterzuur.
* Biologie: Water, een covalent oxide, is essentieel voor het leven.
Vergeet niet dat het begrijpen van de aard van covalente oxiden belangrijk is voor het begrijpen van chemische reacties en hun implicaties op verschillende gebieden.
 Kleine eilanden pleiten voor actie bij VN-klimaatoverleg
Kleine eilanden pleiten voor actie bij VN-klimaatoverleg Vintage film laat zien dat de Thwaites Glacier-ijsplaat sneller smelt dan eerder werd waargenomen
Vintage film laat zien dat de Thwaites Glacier-ijsplaat sneller smelt dan eerder werd waargenomen Metaalverontreiniging Tasmaanse meren een van de ergste ter wereld
Metaalverontreiniging Tasmaanse meren een van de ergste ter wereld Hoe een temperatuurstijging van 1,5 graden Celsius aanzienlijke veranderingen bij kustsoorten kan veroorzaken
Hoe een temperatuurstijging van 1,5 graden Celsius aanzienlijke veranderingen bij kustsoorten kan veroorzaken  Orkanen plannen
Orkanen plannen
Hoofdlijnen
- Wat is een Uwerty?
- Onderzoekers onthullen hoe een dodelijke schimmelinfectie verandert in een invasief monster
- Wie bestudeert de relatie tussen organismen en hun omgeving?
- Wetenschappers zetten primaten tegenover zoogdieren met kleinere hersenen om erachter te komen wie de slimste verzamelaar is
- Wat motiveert de verkoop van bestuivervriendelijke planten?
- Wat zijn de organismen ontdekt door Jose Rizal?
- Stembesturing:waarom Noord-Atlantische walvissen van stem veranderen naarmate ze ouder worden
- Hoe neemt een forel zuurstof in?
- Feiten over lipiden
- Wetenschappers bakken glutenvrij brood met een revolutionaire technologie

- Efficiënte en high-throughput techniek om de structuur van DNA te bestuderen

- Wetenschappers onderzoeken macrocyclische peptiden als nieuwe medicijnsjablonen

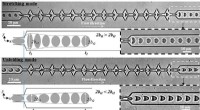
- Door pneumatiek te combineren met een hydrogel om een baromorf te creëren - voor zachte robotica
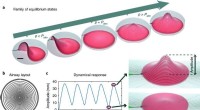
- Hoe bloedcellen vervormen, herstellen wanneer u door kleine kanalen reist
 Wat vormt protonen neutronen en elektronen die beginnen met de letter Q?
Wat vormt protonen neutronen en elektronen die beginnen met de letter Q?  Airbus sluit anticorruptieovereenkomsten met Frankrijk, VK, ons
Airbus sluit anticorruptieovereenkomsten met Frankrijk, VK, ons Verbeterd patent voor raketmotor met vloeibare zuurstof-propyleen weerspiegelt de visie van het bedrijf in baanpogingen
Verbeterd patent voor raketmotor met vloeibare zuurstof-propyleen weerspiegelt de visie van het bedrijf in baanpogingen Welke belangrijke wetenschappelijke conclusies bereikte Aristarchus een astronoom?
Welke belangrijke wetenschappelijke conclusies bereikte Aristarchus een astronoom?  Wat is de rol van chondrion in dierencellen?
Wat is de rol van chondrion in dierencellen?  Milieuwetenschappers nieuwe ozonisatiemethode behandelt water van antibioticaresiduen
Milieuwetenschappers nieuwe ozonisatiemethode behandelt water van antibioticaresiduen Nieuwe benadering van onderzoek naar vogelnavigatie leidt tot ontwikkeling van besluitvormingsmodel voor dieren
Nieuwe benadering van onderzoek naar vogelnavigatie leidt tot ontwikkeling van besluitvormingsmodel voor dieren PEMDAS:De volgorde van bewerkingen van wiskunde onthouden
PEMDAS:De volgorde van bewerkingen van wiskunde onthouden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

