
Wetenschap
De ionisatie -energie voor natrium is 496 kjmol elektronenaffiniteit chloor -349 Wat de enthalpie?
Inzicht in de concepten
* ionisatie -energie: De energie die nodig is om één elektron uit een atoom in zijn gasvormige toestand te verwijderen.
* Elektronenaffiniteit: De energieverandering die optreedt wanneer een elektron wordt toegevoegd aan een neutraal atoom in zijn gasvormige toestand.
* Enthalpy of Formation: De enthalpiewijziging wanneer een mol van een compound wordt gevormd uit zijn elementen in hun standaardstaten.
stappen
1. Schrijf de gebalanceerde chemische vergelijking:
Na (G) + 1/2 Cl₂ (G) → NaCl (G)
2. Identificeer de betrokken processen:
* ionisatie van natrium: Na (g) → Na⁺ (g) + e⁻ (vereist +496 kJ/mol)
* Dissociatie van chloor: 1/2 Cl₂ (G) → Cl (G) (dit vereist energie, maar we hoeven het niet te berekenen voor dit specifieke probleem)
* Elektronenaffiniteit van chloor: Cl (G) + E⁻ → Cl⁻ (G) (geeft -349 kJ/mol af)
* Vorming van NaCl: Na⁺ (G) + Cl⁻ (G) → NaCl (G) (dit is de enthalpie van formatie die we willen vinden)
3. Pas de wet van Hess toe:
De wet van Hess stelt dat de enthalpiewijziging voor een algemene reactie de som is van de enthalpiewijzigingen voor elke individuele stap.
Daarom kan de enthalpie van de vorming van NaCl worden berekend als:
Enthalpy of Formation (NaCl) =ionisatie -energie (Na) + elektronenaffiniteit (CL)
4. Bereken:
Formatie -enthalpie (NaCl) =+496 kJ/mol - 349 kJ/mol =+147 kJ/mol
Conclusie
De enthalpie van de vorming van natriumchloride (NaCl) is +147 kJ/mol. Dit betekent dat de vorming van één mol NaCl uit zijn elementen in hun standaardstaten 147 kJ energie vereist.
 Welke eigenschappen hebben Arrhenius-zuren gemeen?
Welke eigenschappen hebben Arrhenius-zuren gemeen?  Bio-hernieuwbaar proces kan groen plastic helpen
Bio-hernieuwbaar proces kan groen plastic helpen Team ontwikkelt eenvoudige hydrogel-modificatiemethode voor rekbare en transparante elektronica
Team ontwikkelt eenvoudige hydrogel-modificatiemethode voor rekbare en transparante elektronica Bacteriën gebruiken om een waterfilter te maken dat bacteriën doodt
Bacteriën gebruiken om een waterfilter te maken dat bacteriën doodt Waarom is het pH -bereik vastgesteld?
Waarom is het pH -bereik vastgesteld?
 Mensen hebben de afgelopen 35 jaar minstens 250.000 hectare aan riviermondingen omgebouwd tot steden en boerderijen, zo blijkt uit onderzoek
Mensen hebben de afgelopen 35 jaar minstens 250.000 hectare aan riviermondingen omgebouwd tot steden en boerderijen, zo blijkt uit onderzoek  Vijvers voor stormwaterbeheer bieden mogelijk geen oplossing voor het uitputten van wetlands
Vijvers voor stormwaterbeheer bieden mogelijk geen oplossing voor het uitputten van wetlands Zoogdieren gevonden in Louisiana
Zoogdieren gevonden in Louisiana  Wat zijn de zeven basiskrachten van de natuur?
Wat zijn de zeven basiskrachten van de natuur?  Het synchroniseren van de voedselproductie kan desastreuze gevolgen hebben
Het synchroniseren van de voedselproductie kan desastreuze gevolgen hebben
Hoofdlijnen
- Waarom wordt penicillium geclassificeerd als deuteromycota?
- Wat zijn enkele voedselvoorbeelden van eiwitten?
- Welke cellen werken met rode bloedcellen?
- Mijnwerkers schakelen over op bijenteelt
- Studie:Hoe roodrot suikerriet aantast
- Hoe wordt DNA gebruikt in de microbiologie?
- Welke organen zijn betrokken bij homeostase?
- Replicatie die tussen sites voorkomt, wordt?
- Wat is cisgeen organisme?
- Huidig model voor opslag kernafval is onvolledig

- Directe koppeling van arylhalogeniden en alkyllithiumverbindingen door palladiumkatalyse
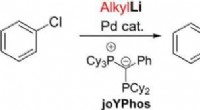
- Door koper gekatalyseerde enantioselectieve trifluormethylering van benzylische radicalen ontwikkeld

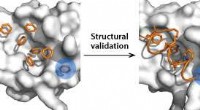
- Op benzeen gebaseerde sondes markeren twee verborgen bindingsplaatsen op een doelwit tegen kanker
- Meegaan met de DNA-stroom:molecuul van het leven vindt nieuwe toepassingen in micro-elektronica

 Wie zijn de verschillende biologen en hun bijdragen aan de ontwikkeling van de biologische biotechnologie?
Wie zijn de verschillende biologen en hun bijdragen aan de ontwikkeling van de biologische biotechnologie?  Wil je weten wat oude koala's aten? Controleer moderne koala's tanden
Wil je weten wat oude koala's aten? Controleer moderne koala's tanden Wat was ontdekking op elektriciteit?
Wat was ontdekking op elektriciteit?  Prototype van een hoge temperatuur warmtepomp voor het terugwinnen van industriële restwarmte
Prototype van een hoge temperatuur warmtepomp voor het terugwinnen van industriële restwarmte Wat is een zonnelamp?
Wat is een zonnelamp?  Hoe geeft elektriciteit energie af?
Hoe geeft elektriciteit energie af?  Hoeveel planeten in het zonnestelsel inclusief Pluto?
Hoeveel planeten in het zonnestelsel inclusief Pluto?  Wat zijn de namen van aardlagen op volgorde?
Wat zijn de namen van aardlagen op volgorde?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

