
Wetenschap
Welke eigenschappen hebben Arrhenius-zuren gemeen?
- Zure smaak:Arrheniuszuren hebben een zure smaak, zoals de smaak van citroensap of azijn.
- Reageren met metalen:Arrhenius-zuren reageren met metalen om waterstofgas te produceren. Wanneer bijvoorbeeld zoutzuur (HCl) aan ijzer (Fe) wordt toegevoegd, ontstaat waterstofgas (H2) en ijzer(II)chloride (FeCl2).
- Reageren met basen:Arrhenius-zuren reageren met basen om zout en water te produceren. Wanneer bijvoorbeeld zoutzuur (HCl) wordt toegevoegd aan natriumhydroxide (NaOH), ontstaat er natriumchloride (NaCl) en water (H2O).
- Verander de kleur van indicatoren:Arrhenius-zuren veranderen de kleur van bepaalde indicatoren, zoals lakmoespapier of fenolftaleïne. Lakmoespapier wordt bijvoorbeeld rood als het in een zure oplossing wordt gedompeld.
- Elektrische geleidbaarheid:Arrhenius-zuren geleiden elektriciteit wanneer ze zijn opgelost in water. Dit komt doordat de H+-ionen die vrijkomen door het zuur zich vrij in het water kunnen bewegen en een elektrische lading met zich meedragen.
Het is belangrijk op te merken dat Arrhenius-zuren een ouder concept in de scheikunde zijn. Moderne theorieën over zuren en basen (zoals de Bronsted-Lowry-theorie of de Lewis-theorie) bieden een vollediger begrip van zuurgedrag dat verder gaat dan het concept van de afgifte van waterstofionen.
 Waarom zijn koolstof-waterstofbindingen langer dan in?
Waarom zijn koolstof-waterstofbindingen langer dan in?  Onderzoekers ontvouwen geheime stabiliteit van buigzame rietjes
Onderzoekers ontvouwen geheime stabiliteit van buigzame rietjes Wanneer de vergelijking Fe3O4 plus Al - Al2O3 Fe correct in evenwicht is, welke coëfficiënt van Fe?
Wanneer de vergelijking Fe3O4 plus Al - Al2O3 Fe correct in evenwicht is, welke coëfficiënt van Fe?  Wat is het H2O2 periodiek systeemelement?
Wat is het H2O2 periodiek systeemelement?  Hoe zou het ontbreken van een co-factor voor een enzym de enzymen beïnvloeden?
Hoe zou het ontbreken van een co-factor voor een enzym de enzymen beïnvloeden?
 Hoe meer overstromingen als gevolg van klimaatverandering de waterwegen in de VS beïnvloeden
Hoe meer overstromingen als gevolg van klimaatverandering de waterwegen in de VS beïnvloeden Klimaatverandering niet de enige bedreiging voor kwetsbare soorten, habitat is belangrijk
Klimaatverandering niet de enige bedreiging voor kwetsbare soorten, habitat is belangrijk Hoe een temperatuurstijging van 1,5 C significante veranderingen kan veroorzaken in kustsoorten
Hoe een temperatuurstijging van 1,5 C significante veranderingen kan veroorzaken in kustsoorten Wat is de natuurlijke habitat van een egel?
Wat is de natuurlijke habitat van een egel?  Wetenschappers brouwen lava en blazen het op om vulkanen beter te begrijpen
Wetenschappers brouwen lava en blazen het op om vulkanen beter te begrijpen
Hoofdlijnen
- Giftige Death Cap-paddenstoel verspreidt zich over Noord-Amerika
- Hoe adaptieve veranderingen in cellulaire vloeistoffen het zeeleven in staat stellen om te gaan met abiotische stressoren
- Computermodellen leggen uit hoe dieren acties selecteren met lonende resultaten
- Hoe een moleculaire motor in een netwerk beweegt
- Onderzoekers tonen aan dat RNA-ribozymen in staat zijn om samen te werken en zichzelf weer in elkaar te zetten
- Nieuwe techniek helpt onderzoekers bepalen hoe stamcellen differentiëren
- De kristalstructuur laat zien hoe motoreiwit werkt
- Internationale concurrentiebenchmarks metagenomics-software
- Wat gebeurt er met plantaardige en dierlijke cellen wanneer ze worden geplaatst in hypertone, hypotone en isotone omgevingen?
- Een fluorogene sonde kan de activiteit van multiresistente pathogenen in een testsysteem detecteren
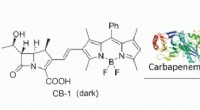
- Het vergelijken van cryogene structuren met monsters op kamertemperatuur kan helpen bij het identificeren van fouten in rekenmodellen
- Glas uit een 3D-printer

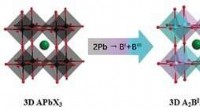
- Onderzoekers ontwikkelen halide dubbele perovskiet ferro-elektriciteit
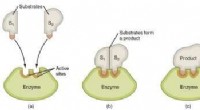
- Het perspectief op de oorsprong van enzymatische katalytische kracht veranderen
 Vergroening van citrusvruchten behandelen met koper:effecten op bomen, bodems
Vergroening van citrusvruchten behandelen met koper:effecten op bomen, bodems Klimaatwetenschappers negeren steeds meer de ecologische rol van inheemse volkeren
Klimaatwetenschappers negeren steeds meer de ecologische rol van inheemse volkeren VN-chef zegt dat de oorlog van de mensheid tegen de natuur moet stoppen
VN-chef zegt dat de oorlog van de mensheid tegen de natuur moet stoppen Hoe de spronghoogte te berekenen van Acceleration
Hoe de spronghoogte te berekenen van Acceleration Slechts één op de drie meisjes haalt de middelbare school in Senegal:hier is waarom en hoe dit op te lossen
Slechts één op de drie meisjes haalt de middelbare school in Senegal:hier is waarom en hoe dit op te lossen  Netflix kondigt documentaireserie aan over Inspiration4 ruimtemissie
Netflix kondigt documentaireserie aan over Inspiration4 ruimtemissie Rijke landen moeten betalen voor klimaatschade:NGO's
Rijke landen moeten betalen voor klimaatschade:NGO's Wat is een evenwichtige vergelijking voor synthese?
Wat is een evenwichtige vergelijking voor synthese?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

