
Wetenschap
Wat reageert met calcium om een ionische binding te maken?
* halogenen:
* fluor (f): Calciumfluoride (CAF₂), gevonden in tandpasta.
* chloor (CL): Calciumchloride (CaCl₂), gebruikt om wegen te de-ice.
* Bromine (Br): Calciumbromide (Cabr₂), gebruikt in fotografie.
* jodium (i): Calciumjodide (CAI₂), gebruikt als voedingssupplement.
* zuurstof (O): Calciumoxide (CAO), ook bekend als QuickLime, is een belangrijk onderdeel van cement.
* zwavel (s): Calciumsulfide (CAS), gebruikt bij de productie van pigmenten.
* stikstof (n): Calciumnitride (Ca₃n₂), een verbinding gevonden in sommige meststoffen.
Hoe ionische bindingen zich vormen met calcium:
1. Calcium verliest elektronen: Calcium heeft twee valentie -elektronen (elektronen in de buitenste schaal). Om een stabiel octet (8 elektronen) te bereiken, verliest het gemakkelijk deze twee elektronen en vormt het een positief geladen calciumion (ca²⁺).
2. Niet -metalen winst elektronen: Niet -metalen krijgen elektronen om een stabiel octet te bereiken. Chloor heeft bijvoorbeeld één elektron nodig om zijn octet te voltooien.
3. Elektrostatische aantrekkingskracht: De tegengesteld geladen ionen (Ca²⁺ en Cl⁻ in het geval van calciumchloride) trekken elkaar sterk aan vanwege elektrostatische krachten, waardoor een ionische binding wordt gevormd.
Belangrijke opmerking: Het specifieke niet -metaal dat reageert met calcium bepaalt de formule van de gevormde ionische verbinding. Calcium reageert bijvoorbeeld met fluor om CAF₂ te vormen (één calciumatoom verliest twee elektronen en twee fluoratomen krijgen elk één elektron).
 Orkanen en aardbevingen:kan de een de ander voorspellen?
Orkanen en aardbevingen:kan de een de ander voorspellen? De beste manier om een koningin te vangen Ant
De beste manier om een koningin te vangen Ant 30 jaar genezing van de ozonlaag
30 jaar genezing van de ozonlaag 10 dingen die de opwarming van de aarde niet weerleggen
10 dingen die de opwarming van de aarde niet weerleggen  315 atoombommen en aanhoudend lijden:de beschamende geschiedenis van kernproeven in Australië en de Stille Oceaan
315 atoombommen en aanhoudend lijden:de beschamende geschiedenis van kernproeven in Australië en de Stille Oceaan
Hoofdlijnen
- De eerste gekweekte Chesapeake-zalm versus de laatste steur? Voorgestelde viskwekerij aan de oostkust wekt bezorgdheid op
- Hoe beïnvloeden sponstoxines mensen?
- Wat is een ander woord voor kenmerken in de wetenschap?
- Wat is uitbreiding in wetenschappelijke termen?
- Bevat multicellulair organisme triljoenen cellen?
- Wat zijn de belangrijkste overtuigingen die een christelijke wetenschapper moet hebben?
- Your Brain On: An All Nighter
- Regenboogpauwspinnen kunnen nieuwe optische technologieën inspireren
- Ware of valse cellen groeperen samen om organen te vormen en weefsel te combineren?
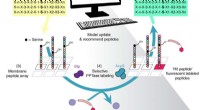
- Machine learning gebruiken om peptiden te ontwerpen
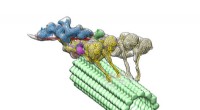
- Microscopische strijdwagens leveren moleculen in onze cellen
- de tijdloze, complementaire smaak van oesters en champagne - uitgelegd

- Ingenieurs 3D printen zeer sterk aluminium, los eeuwenoud lasprobleem op met nanodeeltjes

- Honingraatstructuur met zuurstofarme poriën gevonden in oxideschaal op kleine, op lood gebaseerde reactormaterialen

 Welke fossielen zijn in diamant?
Welke fossielen zijn in diamant?  Verbetering van kwantumpuntinteracties, één laag per keer
Verbetering van kwantumpuntinteracties, één laag per keer De Amazone staat in brand:hier zijn 5 dingen die je moet weten
De Amazone staat in brand:hier zijn 5 dingen die je moet weten Gigantische aardbevingen:niet zo willekeurig als gedacht
Gigantische aardbevingen:niet zo willekeurig als gedacht Welk type stof kan elektriciteit in de vloeistof leiden maar niet vaste fase?
Welk type stof kan elektriciteit in de vloeistof leiden maar niet vaste fase?  Is rubber een isolator van elektriciteit?
Is rubber een isolator van elektriciteit?  Welk element heeft een atomaire massa van 58.7?
Welk element heeft een atomaire massa van 58.7?  Wat zijn de favoriete nummers van Londen? Die van Sydney? Rio's? Spotify brengt de muziek in kaart
Wat zijn de favoriete nummers van Londen? Die van Sydney? Rio's? Spotify brengt de muziek in kaart
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

