
Wetenschap
Waarom is de reactie van ethene en chloor geen reactie in de vrije radicale toevoeging?
* mechanisme: Vrije radicale reacties omvatten de vorming van zeer reactieve soorten met ongepaarde elektronen. De reactie van ethene en chloor verloopt door een tweestapsmechanisme met elektrofiele aanval .
* Stap 1: Het chloormolecuul (Cl 2 ) wordt gepolariseerd door de dubbele binding in Ethene. Dit creëert een gedeeltelijke positieve lading op het ene chlooratoom en een gedeeltelijke negatieve lading aan het andere.
* Stap 2: Het elektrofiele chlooratoom valt de elektronenrijke dubbele binding van ethene aan en vormt een carbocatie tussenliggend. Het andere chlooratoom valt vervolgens de carbocatie aan om het eindproduct te vormen, 1,2-dichloorethaan.
* voorwaarden: Vrije radicale reacties vereisen meestal hoge temperaturen of de aanwezigheid van initiatiefnemers om radicalen te genereren. De reactie van etheen en chloor kan optreden bij kamertemperatuur of zelfs lagere temperaturen, wat aangeeft dat het geen vrije radicalen omvat.
* Producten: Vrije radicale reacties leiden vaak tot een mengsel van producten vanwege de niet-specifieke aard van radicale aanval. De reactie van ethene en chloor geeft daarentegen een enkel groot product , 1,2-dichloorethaan.
Samenvattend: De reactie van etimen en chloor is een elektrofiele toevoegingsreactie omdat het de aanval van een elektrofiele soort (chloor) op een elektronenrijk alkeen inhoudt. De reactie verloopt via een specifiek mechanisme en omvat geen vrije radicalen.
 Chemische stof in cellen van mariene organismen stelt hen in staat de hoge druk in diepe oceanen te overleven
Chemische stof in cellen van mariene organismen stelt hen in staat de hoge druk in diepe oceanen te overleven Wat is een chemische verandering als kaarsen brandt?
Wat is een chemische verandering als kaarsen brandt?  Hoe gaat u rechtvaardigen dat water een verbinding is?
Hoe gaat u rechtvaardigen dat water een verbinding is?  Als 2,10 g NaHCO3 wordt afgebroken, hoeveel gram water wordt er dan geproduceerd?
Als 2,10 g NaHCO3 wordt afgebroken, hoeveel gram water wordt er dan geproduceerd?  Wat is een veiligheidsprobleem met Americium-241?
Wat is een veiligheidsprobleem met Americium-241?
 met 30, 000 enquêtes, onderzoekers bouwen de go-to-dataset voor kleine boerenbedrijven
met 30, 000 enquêtes, onderzoekers bouwen de go-to-dataset voor kleine boerenbedrijven Wat is de omgeving van een plek?
Wat is de omgeving van een plek?  Opkomst en ondergang van waterblaren bieden een glimp onder de dikke ijskap van Groenland
Opkomst en ondergang van waterblaren bieden een glimp onder de dikke ijskap van Groenland Wat geven planten levende wezens?
Wat geven planten levende wezens?  Hydro-elektrische dammen kunnen de toekomst van de Amazone in gevaar brengen
Hydro-elektrische dammen kunnen de toekomst van de Amazone in gevaar brengen
Hoofdlijnen
- Wat is watervrij of watervrij?
- Evolutie is de geleidelijke verandering in fenotypefrequentie van een soort welk proces veroorzaakt evolutie?
- Genetica biedt de sleutel tot de strijd tegen doornenkroonzeesterren
- Wat is het verschil tussen autotrofe en heterotrofe cellen?
- Wat zijn de functies van verschillende witte bloedcellen?
- Welke structuur in de cel bevat spijsverteringsenzymen die koolhydraten afbreken?
- Welke informatie kan niet worden verkregen uit het Human Genome Project?
- Hoe herken je biologische diversiteit?
- Wat gebeurt er met een plant op cellulair niveau wanneer deze van water is beroofd?
- Onderzoekers gebruiken een synthetische tong om whisky's te sorteren
- Geowetenschappers onthullen ijzige kristalstructuren van hagelstenen

- Niet-vluchtig geheugen zo snel als RAM met de capaciteit van flash
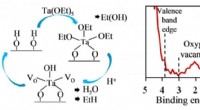
- Elementen in planten gebruiken om de efficiëntie van de brandstofcel te verhogen en tegelijkertijd de kosten te verlagen

- Onderzoekers voorspellen falen in ongeordende materialen
 Hoe pak je de zandgrond op panfu op?
Hoe pak je de zandgrond op panfu op?  Concept van nul is eeuwen ouder dan aangenomen,
Concept van nul is eeuwen ouder dan aangenomen,  Flexibele aanpak van zonnecelfabrikanten brengt hernieuwbare energie naar ongekende plaatsen
Flexibele aanpak van zonnecelfabrikanten brengt hernieuwbare energie naar ongekende plaatsen Wat is de verandering in frequentie van een golf die wordt geproduceerd door de bewegende bron?
Wat is de verandering in frequentie van een golf die wordt geproduceerd door de bewegende bron?  UK review dringt aan op nieuwe regels om de macht van technische giganten aan te pakken
UK review dringt aan op nieuwe regels om de macht van technische giganten aan te pakken Nieuwe techniek om de chemische samenstelling en structuur van monsters te karakteriseren
Nieuwe techniek om de chemische samenstelling en structuur van monsters te karakteriseren Hoe berekent u de versnelling als gevolg van de zwaartekracht?
Hoe berekent u de versnelling als gevolg van de zwaartekracht?  Wat is de geschatte absolute locatieloogte en breedtegraad van Philadelphia?
Wat is de geschatte absolute locatieloogte en breedtegraad van Philadelphia?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

