
Wetenschap
Wat zou er gebeuren met de snelheid van een reactie met Law KNO2H2 als concentratie NO werd verdubbeld?
Inzicht in de tariefwet
De snelheidswet vertelt ons hoe de snelheid van een reactie verandert met de concentratie van de reactanten. Het wordt meestal in de vorm geschreven:
* tarief =k [a]^m [b]^n
Waar:
* tarief is de snelheid van de reactie.
* K is de snelheidsconstante (een specifieke waarde voor de reactie).
* [a] en [b] zijn de concentraties van reactanten A en B.
* m en n zijn de bestellingen van de reactie ten opzichte van respectievelijk A en B. Deze exponenten bepalen hoe de concentratie van elke reactant de snelheid beïnvloedt.
De specifieke tariefwet in kwestie
U hebt een tariefwet gegeven: KNO2H2 . Laten we aannemen dat dit betekent:
* tarief =k [nee]^2 [H2]
Het effect van verdubbeling [nee]
In deze snelheidswet wordt de concentratie van NO verhoogd tot de kracht van 2. Dit betekent dat de reactie de tweede orde is ten opzichte van NO. Hier is hoe het tarief verandert:
* Als u verdubbelt [nee], zal de snelheid met een factor 2^2 =4 toenemen.
Samenvattend:
Het verdubbelen van de concentratie van NO in een reactie met de snelheidswet KNO2H2 zal de snelheid van de reactie verviervoudigen (met een factor 4).
 Orkaan Isaias raast door Bahama's terwijl Florida zich voorbereidt
Orkaan Isaias raast door Bahama's terwijl Florida zich voorbereidt Welke kwaliteiten hebben zowel de omvang als de richting?
Welke kwaliteiten hebben zowel de omvang als de richting?  Het ontsluiten van de klimaatgeheimen van Noord-China met eeuwenoude boomringen
Het ontsluiten van de klimaatgeheimen van Noord-China met eeuwenoude boomringen  NASA-ballonmissie legt elektrisch blauwe wolken vast
NASA-ballonmissie legt elektrisch blauwe wolken vast Overstromingen door moesson in India meer dan 200 doden
Overstromingen door moesson in India meer dan 200 doden
Hoofdlijnen
- Waarom zieke nertsen de zorgen over de vogelgriep doen herleven
- Wat is antimaterie en waarom doet het ertoe?
- Hoe diepe hersenstimulatie werkt
- Waarom worden eiwitten niet gebruikt bij de ademhaling?
- Honingbijen stemmen om te beslissen over nestplaatsen – waarom we zouden moeten luisteren
- Door geplande experimenten online te volgen, kunnen manieren worden gevonden om dierproeven te verbeteren
- Hoe verhoudt het aantal chromosomen in een zygote zich tot dat van de lichaamscel?
- Welke functie die uniek is voor vrouwelijke zoogdieren is het klasse Mammalia genoemd?
- De 'stille code' van eiwitten beïnvloedt de manier waarop cellen bewegen
- Asymmetrische joodverestering van eenvoudige alkenen door concerto-katalysator
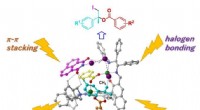
- Dat nieuwe garen?! - Draagbaar, wasbare textielapparaten zijn mogelijk met MXene-gecoate garens

- Quantum wapening:Quantum dots verbeteren de stabiliteit van perovskietkristallen die zonne-energie oogsten

- Doorbraak in magnesiumbatterijen:nanogestructureerde kathode, begrip van nieuwe elektrolyt leidt tot grotere efficiëntie
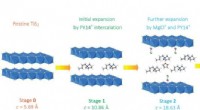
- Nieuwe AI-techniek kan leiden tot innovaties in biomaterialen

 Het water en het zweet opzuigen - een nieuw superdroogmiddel
Het water en het zweet opzuigen - een nieuw superdroogmiddel Waarom bestaat terminale snelheid?
Waarom bestaat terminale snelheid?  Sterren produceren energie door waterstof te combineren?
Sterren produceren energie door waterstof te combineren?  Wat is een voorbeeld van een kernreactie?
Wat is een voorbeeld van een kernreactie?  Welke van de volgende reacties is geen redoxreactie?
Welke van de volgende reacties is geen redoxreactie?  De exitpoll:wat is het, hoe is het zo'n nauwkeurige voorspelling van de verkiezingsresultaten geworden?
De exitpoll:wat is het, hoe is het zo'n nauwkeurige voorspelling van de verkiezingsresultaten geworden?  Lang gezochte eiwitstructuur kan helpen onthullen hoe 'genschakelaar' werkt (video)
Lang gezochte eiwitstructuur kan helpen onthullen hoe 'genschakelaar' werkt (video)  Hoe atomen te 'superchargen' met röntgenlaser
Hoe atomen te 'superchargen' met röntgenlaser
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

