
Wetenschap
Waarom is kaliummanganaat 7 meer oplosbaar in hexaan dan water?
Dit is waarom:
* polariteit: Water is een zeer polair oplosmiddel, wat betekent dat het een significant verschil heeft in ladingsverdeling in het molecuul. Kaliummanganaat is ook een ionische verbinding, wat betekent dat het oplost in geladen ionen (k⁺ en mno₄⁻) in oplossing. Polaire oplosmiddelen zoals water oplossen ionen effectief, waardoor ze kunnen oplossen.
* Niet-polariteit: Hexane daarentegen is een niet-polair oplosmiddel. Het heeft geen significante ladingsscheiding en kan niet effectief interageren met de geladen ionen van kaliummanganaat.
Daarom is kaliummanganaat veel meer oplosbaar in water (een polair oplosmiddel) dan in hexaan (een niet-polair oplosmiddel).
Het principe van "Like Lost Like" is hier van toepassing:polaire stoffen lossen goed op in polaire oplosmiddelen en niet-polaire stoffen lossen goed op in niet-polaire oplosmiddelen.
 Is H2O warm water en CO2 koud water?
Is H2O warm water en CO2 koud water?  Op welke twee manieren verschillen mengsels van verbindingen?
Op welke twee manieren verschillen mengsels van verbindingen?  Honderd milliliter water kan 36 gram zout oplossen bij kamertemperatuur Hoeveel moet worden toegevoegd aan 25 ml dit voor de oplossing bereikt verzadiging?
Honderd milliliter water kan 36 gram zout oplossen bij kamertemperatuur Hoeveel moet worden toegevoegd aan 25 ml dit voor de oplossing bereikt verzadiging?  Materiaal en coatingproces om keramische onderdelen te beschermen
Materiaal en coatingproces om keramische onderdelen te beschermen Wat zijn de 4 stikstofbasis?
Wat zijn de 4 stikstofbasis?
 WHO slaat alarm over ziekte in door overstromingen getroffen gebieden van Pakistan
WHO slaat alarm over ziekte in door overstromingen getroffen gebieden van Pakistan Nieuw onderzoek laat zien hoe de opwarming van de aarde onze regenval in de war brengt
Nieuw onderzoek laat zien hoe de opwarming van de aarde onze regenval in de war brengt  Hoe invasief onkruid bosbranden heter en frequenter kan maken
Hoe invasief onkruid bosbranden heter en frequenter kan maken  Het skeletsysteem van zoogdieren
Het skeletsysteem van zoogdieren De afname van de levensduur van bomen in bossen zou een deel van de stijging van de netto koolstofopname kunnen neutraliseren
De afname van de levensduur van bomen in bossen zou een deel van de stijging van de netto koolstofopname kunnen neutraliseren
Hoofdlijnen
- Wat de neus van een mot weet
- Wie gebruikt de wetenschappelijke methode?
- Wat is de wetenschappelijke term voor hersensap?
- Wat is milieuwetenschappen?
- Wat is het verschil tussen aseksuele reproductie en secxtuele reproductie?
- Hoe UEA-onderzoek zou kunnen helpen bij het bouwen van computers uit DNA
- Wat is satelliet -DNA?
- Wat zijn de twee manieren waarop schimmels sporen produceren?
- Waarom is de productie van zaad een van de belangrijkste links in de landbouwindustrie?
- Het eerste hydrogelplatform in zijn soort maakt on-demand productie van medicijnen mogelijk, Chemicaliën

- Magnetische tanden onthuld met behulp van kwantumbeeldvorming

- Nieuwe fotokatalysator verhoogt de efficiëntie van watersplitsing voor schone waterstofproductie
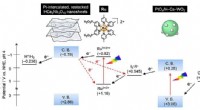
- C. elegans rondwormen oogsten een essentieel co-enzym uit de bacteriën die ze consumeren

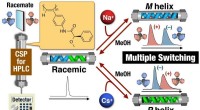
- Multi-state schakelbare stationaire fase opent nieuwe deuren in chirale scheiding
 Hoe magische paddestoelen werken
Hoe magische paddestoelen werken  Wat is een berg die door het wateroppervlak breekt?
Wat is een berg die door het wateroppervlak breekt?  Kan het kunstmatig dimmen van de zon het smelten van ijs voorkomen?
Kan het kunstmatig dimmen van de zon het smelten van ijs voorkomen?  Klimaat in de regio's van Kentucky
Klimaat in de regio's van Kentucky  Geologische en klimaatrecords redden
Geologische en klimaatrecords redden Welk metaal heeft een massa van 61,0 en een volume van 5,40?
Welk metaal heeft een massa van 61,0 en een volume van 5,40?  Astronomen ontwikkelen nieuwe tool om samensmeltende sterrenstelsels te vinden
Astronomen ontwikkelen nieuwe tool om samensmeltende sterrenstelsels te vinden Waarom denk je dat wetenschappers het binnenste van de aarde bestuderen?
Waarom denk je dat wetenschappers het binnenste van de aarde bestuderen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

