
Wetenschap
Welk type binding vormt wanneer natriumchloride NaCl oplost in water?
Dit is waarom:
* ionische bindingen: In vaste NaCl worden natrium (NA) en chloor (CL) ionen bij elkaar gehouden door sterke elektrostatische attracties, waardoor een ionische binding wordt gevormd.
* Oplost in water: Wanneer NaCl in water wordt geplaatst, omringen de polaire watermoleculen de ionen. Het positieve uiteinde van het watermolecuul (waterstof) wordt aangetrokken door de negatief geladen chloride-ionen (Cl-), terwijl het negatieve uiteinde van het watermolecuul (zuurstof) wordt aangetrokken door de positief geladen natriumionen (Na+). Deze attracties worden ion-dipool interacties genoemd .
* het breken van de binding: De sterke aantrekkingskracht tussen de watermoleculen en de ionen overwint de ionische binding die de Na+ en Clionen bij elkaar houdt. Hierdoor breken het NaCl -kristal uit elkaar en worden de ionen omgeven door watermoleculen, waardoor het zout effectief oplost.
Samenvattend: Terwijl ionische bindingen in het proces worden verbroken, is de primaire interactie die verantwoordelijk is voor het oplossen van NaCl in water iondipool interacties .
 Een eenvoudigere manier om B-cellen en T-cellen te differentiëren
Een eenvoudigere manier om B-cellen en T-cellen te differentiëren Wat voor soort chemische reactie wordt aangetoond H2 plus O2 H2O2?
Wat voor soort chemische reactie wordt aangetoond H2 plus O2 H2O2?  Welk volume stikstof bij 215 C en 715 mmHg zou nodig zijn om te reageren met 0,1 mol waterstof en ammoniak te produceren?
Welk volume stikstof bij 215 C en 715 mmHg zou nodig zijn om te reageren met 0,1 mol waterstof en ammoniak te produceren?  Een zeer gevoelig en multi-analytisch systeem voor erfelijke nierziekte
Een zeer gevoelig en multi-analytisch systeem voor erfelijke nierziekte Hoe is kation gerelateerd aan het atoom?
Hoe is kation gerelateerd aan het atoom?
Hoofdlijnen
- Hoe vormen wetenschappers kleinere groepen levende wezens?
- Zijn pH-niveau en enzymen gerelateerd?
- Explosie van ratten, klaverblaadjes, bedmijt, muggen onbedoeld evolutionair gevolg van verstedelijking
- Zelfs wilde zoogdieren hebben regionale dialecten
- Wanneer is een stamcel echt een cel?
- Onderzoekers onthullen een nieuw mechanisme van hyaluronzuur met een specifiek molecuulgewicht om de ontsteking van de gastheer te verbeteren
- Paargebonden Java-mussen vertonen vergrote oogringen om aan te geven dat ze broedgereed zijn
- Hoeveel zintuigen heeft een mens?
- Hoe wordt het genoemd als een procedure waarin iets is gemeten of waargenomen buiten het levende organisme?
- Sterk resorptieve metaal-organische raamwerken
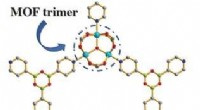
- Chemici maken kunstmatige eiwitten die in het chemische verleden van de aarde kijken

- Wetenschappers onthullen methode om methaangas om te zetten in vloeibare methanol

- Is het mogelijk om anti-aromaticiteit te ontwikkelen door niet-benzenoïde aromatische verbindingen?

- Hybride materiaal brengt transportbrandstofcellen van de volgende generatie dichterbij
 Warmte, vochtigheid houdt het oosten van de VS vast terwijl het weekend ploetert
Warmte, vochtigheid houdt het oosten van de VS vast terwijl het weekend ploetert Is Br2 ionisch polair covalent of covalent?
Is Br2 ionisch polair covalent of covalent?  Een systeem geeft 196 kJ warmte af aan de omgeving en doet 4,20 x 10 2 werken aan wat is verandering in het interne energiesysteem?
Een systeem geeft 196 kJ warmte af aan de omgeving en doet 4,20 x 10 2 werken aan wat is verandering in het interne energiesysteem?  Wat is de definitie van struiklaag?
Wat is de definitie van struiklaag?  Welke soorten bacteriën produceren endosporen?
Welke soorten bacteriën produceren endosporen?  Geluidsgolven sturen deeltjes om zichzelf te assembleren, zelfgenezing
Geluidsgolven sturen deeltjes om zichzelf te assembleren, zelfgenezing Hoe een Petoskey te polijsten Stone
Hoe een Petoskey te polijsten Stone Wat gebeurt er als een magneet telefoon aanraakt?
Wat gebeurt er als een magneet telefoon aanraakt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

