
Wetenschap
Wat is het aantal elektronenschalen?
Hier is hoe het werkt:
* Hoofdkwantumnummer (n): Dit aantal beschrijft het energieniveau van een elektron. Het kan elk positief geheel getal zijn, beginnend met 1.
* elektronenschalen: Elke waarde van 'N' komt overeen met een andere elektronenschil. Dus:
* n =1 vertegenwoordigt de eerste elektronenschil (ook wel de k -shell genoemd).
* n =2 vertegenwoordigt de tweede elektronenschil (L -shell).
* n =3 vertegenwoordigt de derde elektronenschil (m shell).
* Enzovoort.
Bijvoorbeeld:
* waterstof (h): Heeft 1 proton en 1 elektron. De elektronenconfiguratie is 1S¹, wat betekent dat het elektron de eerste elektronenschil in beslag neemt (n =1).
* zuurstof (O): Heeft 8 protonen en 8 elektronen. De elektronenconfiguratie is 1S² 2S² 2P⁴, wat betekent dat de elektronen de eerste twee elektronenschalen bezetten (n =1 en n =2).
belangrijke punten:
* Het aantal elektronenschalen Een atoom heeft de grootte en reactiviteit beperkt.
* Terwijl u naar hogere elektronenschalen gaat (hogere waarden van 'n'), zijn de elektronen verder van de kern en hebben ze een hogere energie.
* Het maximale aantal elektronen dat een bepaalde schaal kan bezetten, wordt bepaald door de formule 2n², waarbij 'n' het belangrijkste kwantumnummer is.
Laat het me weten als je nog andere vragen hebt over elektronenschalen!
 Wat is de kleur van plastic zwavel?
Wat is de kleur van plastic zwavel?  Is het mengen van cocaboeder met water een fysische of chemische verandering?
Is het mengen van cocaboeder met water een fysische of chemische verandering?  Wat is de meest voorkomende lading van elementen voor fosfor?
Wat is de meest voorkomende lading van elementen voor fosfor?  Wat is een denkbeeldig gas dat perfect voldoet aan de kinetische moleculaire theorie die is geroepen?
Wat is een denkbeeldig gas dat perfect voldoet aan de kinetische moleculaire theorie die is geroepen?  Wat is de katalysator in een metabole route?
Wat is de katalysator in een metabole route?
 Gigantische onontdekte grot gevonden in British Columbia
Gigantische onontdekte grot gevonden in British Columbia  Wat is het bodemecosysteem?
Wat is het bodemecosysteem?  Het vervangen van plastic door alternatieven is in de meeste gevallen slechter voor de uitstoot van broeikasgassen, zo blijkt uit onderzoek
Het vervangen van plastic door alternatieven is in de meeste gevallen slechter voor de uitstoot van broeikasgassen, zo blijkt uit onderzoek  Enkele van 's werelds armste mensen dragen de kosten van het behoud van tropische bossen
Enkele van 's werelds armste mensen dragen de kosten van het behoud van tropische bossen De vooruitzichten van Amerikaanse aardbeien
De vooruitzichten van Amerikaanse aardbeien
Hoofdlijnen
- Wat zijn de kenmerken van DNA?
- Wat zijn allemaal biochemische processen van een organisme?
- Is een wetenschappelijke theorie gewoon wilde gok?
- Wat is de functie van een dierenspiercel in het organisme?
- Onderzoekers tonen aan dat koralen moeite hebben om te groeien onder meerdere stressfactoren
- Wat is het kenmerk van een celmembraan dat regelt welke stoffen cel kunnen binnenkomen en verlaten?
- Hoe regelt het eiwit het geslacht van een zich ontwikkelend embryo?
- Wat is de tak van de wetenschap die de mens vergelijkt met biosystemen?
- Wie heeft de evolutie uitgevonden?
- Metaalkatalysatoren die worden gebruikt voor milieuduurzaamheid blijken te degraderen en worden minder effectief
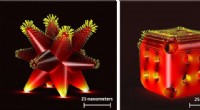
- Wetenschappers stellen een nieuwe strategie voor om het celcommunicatienetwerk te reguleren

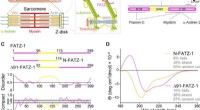
- Orde van wanorde in de sarcomeer
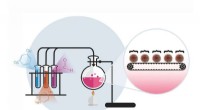
- Chemici ontwikkelen een nieuwe methode voor de synthese van polymere nanodeeltjes van een bepaalde grootte
- Morsen in een nucleaire faciliteit toont potentiële brandwondenrisico's van een huishoudelijke chemische stof

 Wat zijn allemaal verschillende soorten energie?
Wat zijn allemaal verschillende soorten energie?  AI kan steden helpen dure waterlekken op te sporen
AI kan steden helpen dure waterlekken op te sporen Hoe wordt een Boulder -grot gevormd?
Hoe wordt een Boulder -grot gevormd?  Welke menselijke handeling kan een omgeving veranderen?
Welke menselijke handeling kan een omgeving veranderen?  Waar vind je bodem kruipt?
Waar vind je bodem kruipt?  Welke natuurwetenschappelijke wet moet worden gevolgd bij het balanceren van chemische stoffen?
Welke natuurwetenschappelijke wet moet worden gevolgd bij het balanceren van chemische stoffen?  Wat zijn 3 voorbeelden van elastische energie?
Wat zijn 3 voorbeelden van elastische energie?  Op zoek naar het sleutelwoord:Bepaalde woorden in een tekst maken er trefwoorden van
Op zoek naar het sleutelwoord:Bepaalde woorden in een tekst maken er trefwoorden van
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

