
Wetenschap
Wat is het verschil tussen opstelling van elektronen in zwavel en chloor?
Elektronische configuratie:
* zwavel (s): 1S² 2S² 2P⁶ 3S² 3P⁴
* chloor (CL): 1S² 2S² 2P⁶ 3S² 3P⁵
Belangrijkste verschillen:
* Aantal valentie -elektronen: Zwavel heeft 6 Valentie -elektronen (in de 3s en 3p orbitalen), terwijl chloor 7 heeft valentie -elektronen.
* orbitale vulling: Zowel zwavel als chloor hebben hun eerste twee elektronenschalen gevuld (1s en 2s). In de derde schaal heeft Sulphur echter twee elektronen in de 3s orbitale en vier elektronen in de 3P -orbitalen, terwijl chloor twee elektronen in de 3S orbitale en vijf elektronen in de 3P -orbitalen heeft.
Orbitale diagrammen:
Hier is een vereenvoudigde weergave van de elektronenopstelling in de buitenste (valentie) schaal:
* zwavel:
* 3s:↑ ↓
* 3p:↑ ↓ ↑ ↑
* chloor:
* 3s:↑ ↓
* 3P:↑ ↓ ↑ ↓ ↑
Implicaties:
* Chemische reactiviteit: Het verschil in valentie -elektronen beïnvloedt hoe gemakkelijk zwavel en chloor chemische bindingen vormen. Chloor, met één elektron minder dan een volledig octet, heeft de neiging om een elektron te krijgen om een stabiele configuratie te bereiken, waardoor het een sterk oxidatiemiddel is. Zwavel, met twee minder elektronen dan een volledig octet, is minder reactief en kan twee elektronen krijgen of elektronen delen om bindingen te vormen.
* binding: Zwavel kan covalente bindingen vormen met andere elementen door zijn valentie -elektronen te delen. Chloor kan ionische bindingen vormen door een elektron of covalente bindingen te verkrijgen door elektronen te delen.
Samenvattend: Hoewel zowel zwavel als chloor niet -metalen zijn in dezelfde periode (rij) van de periodiek systeem, leidt hun elektronenrangschikking tot verschillende chemische eigenschappen en reactiviteit.
 Koolstoftetrachloride CCL4 is niet -polair Welke krachten houden de moleculen bij elkaar?
Koolstoftetrachloride CCL4 is niet -polair Welke krachten houden de moleculen bij elkaar?  Wat is een voorbeeld van oxide -mineraal?
Wat is een voorbeeld van oxide -mineraal?  Wanneer zijn moleculen van een stof in beweging?
Wanneer zijn moleculen van een stof in beweging?  Water zou de activiteit en selectiviteit van koolstofdioxidereductie kunnen moduleren
Water zou de activiteit en selectiviteit van koolstofdioxidereductie kunnen moduleren Water speelt een onverwachte rol bij de vorming van mineralen
Water speelt een onverwachte rol bij de vorming van mineralen
 Wat is het verschil tussen archeologie en grafroof?
Wat is het verschil tussen archeologie en grafroof?  Koude lucht stijgt op – wat dat betekent voor het klimaat op aarde
Koude lucht stijgt op – wat dat betekent voor het klimaat op aarde  Overblijfselen van vliegtuigcrash uit de Koude Oorlog komen uit de snel smeltende gletsjer van Alaska
Overblijfselen van vliegtuigcrash uit de Koude Oorlog komen uit de snel smeltende gletsjer van Alaska Zes voet onder, een nieuwe benadering van de opwarming van de aarde
Zes voet onder, een nieuwe benadering van de opwarming van de aarde Slag bij Mosul laat erfenis van milieuschade achter
Slag bij Mosul laat erfenis van milieuschade achter
Hoofdlijnen
- Nieuwe aanwijzingen waarom er zo weinig antimaterie in het universum is
- Neuroimaging laat zien hoe ideologie de perceptie van ras beïnvloedt
- Het publiek is minder bang voor haaien als ze hun gedrag begrijpen
- Hoeveel theorieën zijn er en waarvoor?
- Wat is wetenschappelijke hypothesen?
- Als een soort niet over voldoende genenpool beschikt,
- Reusachtig virus ontdekt in afvalwaterzuiveringsinstallatie infecteert dodelijke parasiet
- Hoe gebruiken biologen DNA en RNA om organismen te helpen classificeren?
- Hoe DNA-bewijs werkt
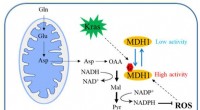
- Wetenschappers identificeren O-GlcNAcylatie als oorzaak van pancreastumorgroei door MDH1 te reguleren
- Sensorpatch van textiel gemaakt met geleidende garens kan drukpunten voor geamputeerden detecteren

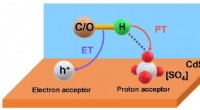
- Door zonlicht en afvalwaternitraat te combineren om 's werelds nummer 2 chemisch te maken

- Eiwitten dateren uit de tijd van sabeltandkatten

- Nieuwe methode stimuleert de vorming van syngas uit biopolyolen
 Als een constante kracht wordt toegepast voor het dubbele van de hoeveelheid tijd, wat gebeurt er dan met de toegepaste impuls?
Als een constante kracht wordt toegepast voor het dubbele van de hoeveelheid tijd, wat gebeurt er dan met de toegepaste impuls?  Griepvirussen doden met hulp van een kikker
Griepvirussen doden met hulp van een kikker Wat zijn 20 dingen die van metaal zijn gemaakt?
Wat zijn 20 dingen die van metaal zijn gemaakt?  Waarom goede mensen online slecht worden
Waarom goede mensen online slecht worden Wat ervaart een object dat op het aardoppervlak rust?
Wat ervaart een object dat op het aardoppervlak rust?  Naam 7 bomen die van commercieel belang zijn in de regio Central Forest?
Naam 7 bomen die van commercieel belang zijn in de regio Central Forest?  Hoe verhoogt u de efficiëntie van een warmtemotor?
Hoe verhoogt u de efficiëntie van een warmtemotor?  Wat is de evenwichtige vergelijking voor bariumnitraat en kaliumfosfaat?
Wat is de evenwichtige vergelijking voor bariumnitraat en kaliumfosfaat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

