
Wetenschap
Waarom zijn de smeltpunten van natriumchloride en jodium heel anders?
Natriumchloride (NaCl):
* ionische binding: NaCl bestaat uit een sterke ionische binding tussen positief geladen natriumionen (Na⁺) en negatief geladen chloride -ionen (CL⁻). Deze ionen zijn gerangschikt in een kristalroosterstructuur.
* Hoog smeltpunt: De elektrostatische aantrekkingskrachten tussen de tegengesteld geladen ionen zijn erg sterk. Om NaCl te smelten, moet je deze sterke krachten overwinnen, waardoor veel energie nodig is. Dit verklaart zijn hoge smeltpunt van 801 ° C.
jodium (i₂):
* Covalente binding: Jodium bestaat als diatomaire moleculen (I₂) bij elkaar gehouden door zwakke intermoleculaire krachten die bekend staan als van der Waals -krachten. Deze krachten komen voort uit tijdelijke schommelingen in elektronenverdeling.
* Laag smeltpunt: De Van der Waals -krachten zijn veel zwakker dan de ionische bindingen in NaCl. Daarom is minder energie nodig om deze krachten te overwinnen en de jodiummoleculen te scheiden, wat resulteert in een laag smeltpunt van 113,7 ° C.
Samenvattend:
* Sterke ionische bindingen: Hoog smeltpunt (NaCl)
* Zwakke van der Waals krachten: Laag smeltpunt (i₂)
 Nieuwe karteringstechnieken stellen onderzoekers in staat om het effect van gletsjerstroom op infrastructuur beter te meten, omgeving
Nieuwe karteringstechnieken stellen onderzoekers in staat om het effect van gletsjerstroom op infrastructuur beter te meten, omgeving Grote toename van de uitstoot van kooldioxide in Nieuw-Zeeland door internationale vluchten
Grote toename van de uitstoot van kooldioxide in Nieuw-Zeeland door internationale vluchten Hoe bouwt een mier zijn heuvel op?
Hoe bouwt een mier zijn heuvel op?  Waarom worden gewassen beter in vulkanische grond?
Waarom worden gewassen beter in vulkanische grond?  Maak een lijst van minstens twee dingen die wetenschappers en ontdekkingsreizigers gemeen hebben?
Maak een lijst van minstens twee dingen die wetenschappers en ontdekkingsreizigers gemeen hebben?
Hoofdlijnen
- Wat is een cel -resPraition?
- Eksters, wulpen, slechtvalken:hoe vogels zich aanpassen aan onze steden, verwondering, vreugde en conflict brengen
- Een vlieg heeft twee allelen voor de kleur van zijn ogen. Het groene allel is recessief en wordt vertegenwoordigd door blauw dominant, p. Als er 28 organismen zijn, welke p?
- Waarom werden dieren uitgevonden?
- Wetenschappers rapporteren chemische basis van de celdelingstimer, een mogelijk doelwit tegen kanker
- Waar vindt reductie plaats in een elektrolytische cel?
- Verschil tussen een eencellige protoctist en bacterie?
- Hoe beïnvloedt de structuur van DNA zijn functie?
- Waarom heeft een plant STEM nodig?
- Biosensor-chip detecteert draadloos single-nucleotide polymorfisme, met hogere gevoeligheid
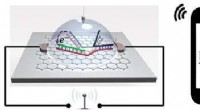
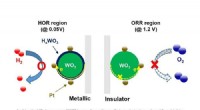
- Wetenschappers lossen een duurzaamheidsprobleem op in brandstofcellen voor waterstofauto's
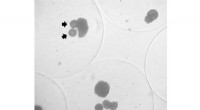
- De code van een vormveranderend eiwit kraken

- Was aan, wegsmelten

- Kleine medicijnafgiftecapsules kunnen getransplanteerde insulineproducerende cellen ondersteunen
 Wat is de naam van alle wetenschapper?
Wat is de naam van alle wetenschapper?  Waarom de felgele pigmenten van Matisse vervagen tot beige
Waarom de felgele pigmenten van Matisse vervagen tot beige  Twee als het over land gaat? Biologen ontdekken dodelijk TTX-toxine in twee terrestrische soorten
Twee als het over land gaat? Biologen ontdekken dodelijk TTX-toxine in twee terrestrische soorten  Welke stoffen worden niet geabsorbeerd in de magnetron?
Welke stoffen worden niet geabsorbeerd in de magnetron?  Welke familie elementen is de meest reactieve niet -metalen familie?
Welke familie elementen is de meest reactieve niet -metalen familie?  Te midden van verwarring, EU-wetgeving inzake gegevensprivacy wordt van kracht
Te midden van verwarring, EU-wetgeving inzake gegevensprivacy wordt van kracht Je stoot waarschijnlijk een verbazingwekkende hoeveelheid koolstofdioxide uit in je dagelijkse routine
Je stoot waarschijnlijk een verbazingwekkende hoeveelheid koolstofdioxide uit in je dagelijkse routine Kunnen tarieven worden gebruikt om de klimaatverplichtingen van Parijs af te dwingen?
Kunnen tarieven worden gebruikt om de klimaatverplichtingen van Parijs af te dwingen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

