
Wetenschap
Wat is de reactie van ijzersulfaatoplossing met kaliumpermanganaat?
Hier is een uitsplitsing van de reactie:
* reactanten:
* IJzer (ii) sulfaat (feso₄)
* Kalium permanganaat (kmno₄)
* Zuur (typisch zwavelzuur, H₂so₄) is vereist om de zure omgeving te bieden voor de reactie.
* Producten:
* IJzer (iii) sulfaat (Fe₂ (So₄) ₃)
* Mangaan (II) Sulfaat (MNSO₄)
* Kaliumsulfaat (k₂so₄)
* Water (H₂o)
De gebalanceerde chemische vergelijking:
10feso₄ + 2kmno₄ + 8h₂so₄ → 5fe₂ (So₄) ₃ + 2mnso₄ + k₂so₄ + 8h₂o
Verklaring:
* oxidatie: IJzer (II) ionen (Fe²⁺) worden geoxideerd tot ijzer (III) ionen (Fe³⁺) door elk een elektron te verliezen.
* reductie: Permanganaationen (MNO₄⁻) worden gereduceerd tot mangaan (II) ionen (Mn²⁺) door elk vijf elektronen te winnen.
Observaties:
* De paarse kleur van de kaliumpermanganaatoplossing vervaagt terwijl deze reageert met de ijzer (II) sulfaatoplossing.
* De oplossing wordt lichtgeel vanwege de vorming van ijzer (III) sulfaat.
belangrijke opmerkingen:
* De reactie vereist een zuur medium voor de permanganaationen om als een oxidatiemiddel te fungeren.
* De reactie is ook gevoelig voor temperatuur en concentratie.
* De reactie wordt gebruikt in titratieanalyse om de concentratie van ijzer (II) ionen in een oplossing te bepalen.
Laat het me weten als je meer details wilt over een van deze aspecten!
 Wat is de evenwichtige vergelijking voor de productie van waterstofchloride van en chloor?
Wat is de evenwichtige vergelijking voor de productie van waterstofchloride van en chloor?  Hoe te verwijderen totaal opgeloste stoffen uit Drinkwater
Hoe te verwijderen totaal opgeloste stoffen uit Drinkwater Wat veroorzaakt een neerslagreactie tussen twee oplosbare verbinding?
Wat veroorzaakt een neerslagreactie tussen twee oplosbare verbinding?  Archaea-enzym dat membraanlipiden produceert, is spectaculair promiscue
Archaea-enzym dat membraanlipiden produceert, is spectaculair promiscue Wat is de oxidatie halfreactie voor 2 mg O22MGO?
Wat is de oxidatie halfreactie voor 2 mg O22MGO?
 Nationaal onderwijsbeleid -- oh, wat is het veranderd
Nationaal onderwijsbeleid -- oh, wat is het veranderd  Hoe Horns & Wasps te identificeren in Tennessee
Hoe Horns & Wasps te identificeren in Tennessee Gevriesdroogde grond is meer geschikt voor het bestuderen van reactieve stikstofgasemissies in de bodem
Gevriesdroogde grond is meer geschikt voor het bestuderen van reactieve stikstofgasemissies in de bodem Wat het klimaatsysteem van de aarde en topologische isolatoren gemeen hebben
Wat het klimaatsysteem van de aarde en topologische isolatoren gemeen hebben  Waarom wordt een boom gebruikt om de evolutietheorie te illustreren?
Waarom wordt een boom gebruikt om de evolutietheorie te illustreren?
Hoofdlijnen
- Welke twee weefsels kunnen niet zo gemakkelijk regenereren?
- Hoe Beschrijf de drie stappen in mendelstudies van erwtenplanten?
- Welk koninkrijk behoren Escherichia coli?
- Kunnen we de kikkerpandemie genezen?
- Uit bevindingen blijkt hoe het dengue-virus volwassen wordt en besmettelijk wordt
- Noem de Tubluar -klieren die worden gevonden tussen bases van darmvilli?
- Plaats deze in volgorde op grootte chromosoom kerncel -DNA en nucleotide?
- Welk product is gebruikelijk IT -reacties in cellulaire ademhaling en gisting?
- Hoe noem je planten met dikke vlezige weefsels?
- IJzercorroderende bacteriën blijken enzymen te bezitten waardoor ze elektronen uit extracellulaire vaste stoffen kunnen halen
- Nieuw onderzoek levert supersterke aluminiumlegering op

- Warmte en licht creëren nieuwe biocompatibele microdeeltjes
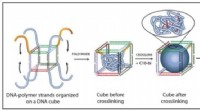
- DNA-strengen gebruiken om nieuwe polymeermaterialen te ontwerpen
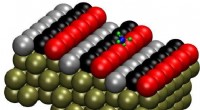
- Het precieze reactiepad lokaliseren:Methaandissociatie op platina
 Zei Armstrong dat je in de Kerstman gelooft als hij op de maan is?
Zei Armstrong dat je in de Kerstman gelooft als hij op de maan is?  Een onderzoek onder bijna 2600 IAU-leden toont aan dat astronomen een opmerkelijke drive hebben voor publieke betrokkenheid
Een onderzoek onder bijna 2600 IAU-leden toont aan dat astronomen een opmerkelijke drive hebben voor publieke betrokkenheid Klimaat overgeleverd aan de politiek in 2020, experts waarschuwen
Klimaat overgeleverd aan de politiek in 2020, experts waarschuwen Bedrijven drukken op de pauzeknop terwijl het coronavirus de economie besmet
Bedrijven drukken op de pauzeknop terwijl het coronavirus de economie besmet Nieuw rapport toont dwingende redenen om sekswerk te decriminaliseren
Nieuw rapport toont dwingende redenen om sekswerk te decriminaliseren Wat zijn vier soorten bio-organische verbindingen?
Wat zijn vier soorten bio-organische verbindingen?  Welke informatie wordt overgedragen van de kern naar ribosoom geroepen?
Welke informatie wordt overgedragen van de kern naar ribosoom geroepen?  Nieuwe online versie van de Chinese onzekerheidsschaal voor onverdraagzaamheid:is deze geldig?
Nieuwe online versie van de Chinese onzekerheidsschaal voor onverdraagzaamheid:is deze geldig?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

