
Wetenschap
Waarom vormen CACL2 en ALCL3 kristallen met dezelfde structuur als NaCl?
1. Ionische binding:
* NaCl: Natriumchloride (NaCl) is een klassiek voorbeeld van een ionische verbinding waar natrium (NA⁺) kationen en chloride (CL⁻) anionen worden bij elkaar gehouden door sterke elektrostatische attracties.
* cacl₂: Calciumchloride (CaCl₂) vertoont ook ionische binding. Calcium (ca²⁺) kationen hebben een +2 lading, terwijl chloride (CL⁻) anionen een -1 lading hebben. De verhouding van 1:2 (Ca²⁺:Cl⁻) brengt de ladingen in evenwicht, wat leidt tot een stabiele ionische verbinding.
* alcl₃: Aluminiumchloride (ALCL₃) is een beetje complexer. Aluminium (Al³⁺) heeft een +3 lading, terwijl chloride (CL⁻) een -1 -lading heeft. De 1:3 -verhouding (Al³⁺:Cl⁻) is vereist voor ladingsneutraliteit.
2. Vergelijkbare grootte en ladingsverhouding:
* Grootte: De ionische stralen van de kationen (Na⁺, Ca²⁺, Al³⁺) en het anion (CL⁻) zijn relatief vergelijkbaar in deze verbindingen. Dit zorgt voor een nauwe verpakkingsopstelling, essentieel voor de structuur van de rotszout.
* ladingsverhouding: De verhouding van kationlading tot anionlaad is vergelijkbaar voor alle drie verbindingen (respectievelijk 1:1, 2:2 en 3:3). Deze gelijkenis draagt bij aan de vorming van een vergelijkbare kristalstructuur.
3. Crystal Packing Efficiency:
* De rotszoutstructuur maximaliseert de elektrostatische interacties tussen kationen en anionen, terwijl afstotende krachten worden geminimaliseerd. Deze opstelling is zeer efficiënt in termen van verpakkingsdichtheid, waardoor het een gemeenschappelijke structuur is voor ionische verbindingen.
4. Coördinatienummer:
* In de rotszoutstructuur hebben zowel het kation als het anion een coördinatienummer van 6. Dit betekent dat elk ion is omgeven door zes ionen van de tegenovergestelde lading. Dit specifieke coördinatienummer wordt begunstigd door de grootte- en ladingsverhouding van de ionen in deze verbindingen.
Belangrijke opmerking: Terwijl CaCl₂ en ALCL₃ kristallen vormen met dezelfde structuur als NaCl bij kamertemperatuur, kunnen ze ook verschillende structuren over specifieke omstandigheden overnemen. Alcl₃ kan bijvoorbeeld verschillende structuren vormen bij hogere temperaturen vanwege de invloed van zijn meer covalente karakter.
Samenvattend, de vergelijkbare ionische aard, grootte, ladingsverhouding en verpakkingsefficiëntie van CACL₂, ALCL₃ en NaCl stellen hen in staat om dezelfde rotzoutstructuur aan te nemen, een gemeenschappelijke en efficiënte opstelling voor ionische verbindingen.
 Nieuw record in loodvrije halide dubbele perovskieten
Nieuw record in loodvrije halide dubbele perovskieten Wat geeft een drie meter lange Amazone-vis enkele van de zwaarste schubben op aarde?
Wat geeft een drie meter lange Amazone-vis enkele van de zwaarste schubben op aarde? IJzercorroderende bacteriën blijken enzymen te bezitten waardoor ze elektronen uit extracellulaire vaste stoffen kunnen halen
IJzercorroderende bacteriën blijken enzymen te bezitten waardoor ze elektronen uit extracellulaire vaste stoffen kunnen halen Van borstimplantaten tot ijsblokjesbakjes - hoe siliconen onze keukens overnamen
Van borstimplantaten tot ijsblokjesbakjes - hoe siliconen onze keukens overnamen Is zuurstof een ionen of neutraal atoom?
Is zuurstof een ionen of neutraal atoom?
Hoofdlijnen
- Wat is de grootte van nucleus met massanummer 216?
- De ziekte is gemakkelijker te verspreiden in de samenleving?
- Hoe te voorkomen dat muggenvissen zich verspreiden in waterecosystemen
- EP-leden dringen aan op onderzoek naar de invloed van Monsanto op onderzoek
- Wat is de algehele structuur van het DNA -molecuul?
- Wat zijn de twee fasen van de menselijke evolutie?
- Hoe de anemoonvis zijn strepen verdiende:evolutie van kleurpatronen bij koraalrifvissen
- De functies van een organismen zijn gerelateerd aan die delen?
- Onderzoek onthult dat controversiële insecticiden giftig zijn voor zangvogels
- Nieuwe verbinding effectief tegen medicijnresistente pathogenen, kan leiden tot nieuwe antibiotica

- Wetenschappers kweken bacteriën die kleine energieke koolstofringetjes maken

- Hoe chemische reacties worden berekend

- Onderzoekers zetten belangrijke stap in de richting van kankerbehandelingen die gezonde cellen ongedeerd laten
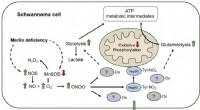
- Verbeterd begrip van baanbrekende vloeibaar-metaal 2D-techniek
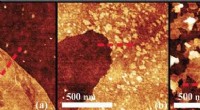
 Wat gebeurt er als natriumhydroxide in olie stroomt?
Wat gebeurt er als natriumhydroxide in olie stroomt?  Heeft de continentale helling een zachte inslag?
Heeft de continentale helling een zachte inslag?  Kwadratische vergelijkingen zoeken in een tabel
Kwadratische vergelijkingen zoeken in een tabel  Wat kan er met je ogen gebeuren als je naar een zonsverduistering staart?
Wat kan er met je ogen gebeuren als je naar een zonsverduistering staart?  Hoe vitaminewater werkt
Hoe vitaminewater werkt  Wat is de nieuw toegevoegde planeet aan het zonnestelsel?
Wat is de nieuw toegevoegde planeet aan het zonnestelsel?  Waarom is de juiste volgorde van DNA-basen belangrijk voor productie-eiwitten?
Waarom is de juiste volgorde van DNA-basen belangrijk voor productie-eiwitten?  Praktisch anoniem communicatieprotocol ontwikkeld voor kwantumnetwerken
Praktisch anoniem communicatieprotocol ontwikkeld voor kwantumnetwerken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

