
Wetenschap
Wat is de reactie tussen loodacetaatoplossing en oplossingen voor kaliumjodide?
pb (ch₃coo) ₂ (aq) + 2ki (aq) → pbi₂ (s) + 2kch₃coo (aq)
Verklaring:
* loodacetaat (PB (ch₃coo) ₂) en kaliumjodide (ki) zijn beide oplosbare ionische verbindingen, wat betekent dat ze dissociëren in hun respectieve ionen in oplossing.
* loodionen (PB²⁺) en jodide -ionen (i⁻) reageren op vorm loodjodide (PBI₂) , een felgele vaste stof die onoplosbaar is in water. Dit is de reden waarom het uit de oplossing neerslaat.
* kaliumionen (k⁺) en acetaationen (ch₃coo⁻) Blijf in oplossing als kaliumacetaat (kch₃coo) , die oplosbaar is in water.
Observaties:
* Wanneer u de twee oplossingen mengt, een felgeel neerslag zal onmiddellijk worden gevormd, wat de vorming van loodjodide aangeeft.
* De reactie is exotherme , wat betekent dat het warmte vrijgeeft en de oplossing kan enigszins warm aanvoelen.
Netto ionische vergelijking:
De netto ionische vergelijking richt zich alleen op de soort die deelnemen aan de vorming van het neerslag:
pb²⁺ (aq) + 2i⁻ (aq) → pbi₂ (s)
Deze vergelijking toont duidelijk de reactie tussen loodionen en jodide -ionen, wat leidt tot de vorming van loodjodide -neerslag.
 Nieuwe MD-simulatie werpt licht op het mysterie van de structuur van gehydrateerde elektronen
Nieuwe MD-simulatie werpt licht op het mysterie van de structuur van gehydrateerde elektronen Wat gebeurt er als u zout en gedestilleerd water mengt?
Wat gebeurt er als u zout en gedestilleerd water mengt?  Experimenten waarbij mondwater wordt gedood Bacteria
Experimenten waarbij mondwater wordt gedood Bacteria Op zoek naar stabiele vloeistoffen
Op zoek naar stabiele vloeistoffen Welke methode is het meest geschikt voor het scheiden van een mengsel van natriumchloride en jodium?
Welke methode is het meest geschikt voor het scheiden van een mengsel van natriumchloride en jodium?
 Wat is reflectie in wetenschappelijke termen?
Wat is reflectie in wetenschappelijke termen?  Vrijhandel kan honger door klimaatverandering voorkomen
Vrijhandel kan honger door klimaatverandering voorkomen Beweging die kennisredenen en wetenschap bevordert om de samenleving te verbeteren?
Beweging die kennisredenen en wetenschap bevordert om de samenleving te verbeteren?  Oostenrijk verhoogt klimaatuitgaven ondanks virushit
Oostenrijk verhoogt klimaatuitgaven ondanks virushit Wat zijn de A -biotische factoren en organismen die in tropisch regenwoud leven?
Wat zijn de A -biotische factoren en organismen die in tropisch regenwoud leven?
Hoofdlijnen
- Wat voor dierengroepen waarvoor een goed fossiel record is dat hun evolutionaire ontwikkeling toont?
- Zijn de stappen in de wetenschappelijke methode elk onderzoek exact hetzelfde?
- Chimpanseepopulaties vertonen een grote genetische diversiteit, met gevolgen voor het natuurbehoud
- Welk type RNA draagt aminozuren naar de vertaalsite?
- Leven paddenstoelen op een boomstronkparasieten?
- Wat gebeurt er met plantaardige en dierlijke cellen wanneer ze worden geplaatst in hypertone, hypotone en isotone omgevingen?
- Gekruiste (evolutionaire) signalen?
- Hoe bacteriën hypothiocyaniet onschadelijk maken, een antimicrobieel wapen van het aangeboren immuunsysteem
- Wat is een Golgi-apparaat?
- Water kan de sleutel zijn tot het begrijpen van zoetheid
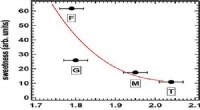
- Nieuwe coating brengt lithium-metaalbatterij dichter bij de realiteit

- Licht schijnt op chemische productiemethode
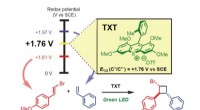
- Elektronisch afval wordt gewonnen voor zeldzame aardelementen

- Draagbare sensoren kunnen biotechnologie gebruiken om persoonlijke, milieugegevens
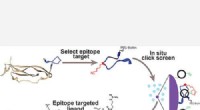
 Wat is het proces waarin zonnepanelen stralen van zon veranderen in energie die wordt genoemd?
Wat is het proces waarin zonnepanelen stralen van zon veranderen in energie die wordt genoemd?  Een aardverschuivingstemperatuur nemen om een catastrofe te voorkomen
Een aardverschuivingstemperatuur nemen om een catastrofe te voorkomen Wat is de term voor alle sedimenten van de oorsprong van gletsjers?
Wat is de term voor alle sedimenten van de oorsprong van gletsjers?  De pandemie van chipmakers slaat om als recessie opdoemt
De pandemie van chipmakers slaat om als recessie opdoemt Wat is inventarisatie in microbiologie?
Wat is inventarisatie in microbiologie?  Wat waren Albert Einsteins ambities?
Wat waren Albert Einsteins ambities?  Droom van energieverzamelende ramen is een stap dichter bij de realiteit
Droom van energieverzamelende ramen is een stap dichter bij de realiteit Wat is de afstand wanneer manen zwaartekracht 0 wordt of de aarde overneemt?
Wat is de afstand wanneer manen zwaartekracht 0 wordt of de aarde overneemt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

