
Wetenschap
Wat gebeurt er als u zout en gedestilleerd water mengt?
1. Oplossing:
* Zout lost op in water. Dit betekent dat de ionische bindingen het natrium (Na+) en chloride (Cl-) ionen in de zoutkristalbreuk vasthouden.
* De watermoleculen omringen de ionen en trekken ze uit elkaar en in de oplossing. Dit proces wordt hydratatie genoemd.
2. Vorming van een elektrolytoplossing:
* De opgeloste ionen, Na+ en Cl- worden vrij om in het water te bewegen.
* Dit maakt de oplossing een elektrolyt , wat betekent dat het elektriciteit kan leiden. Dit komt omdat de geladen ionen een elektrische stroom kunnen vervoeren.
3. Verandering in eigenschappen:
* De oplossing heeft nu een hoger kookpunt en een lager vriespunt dan zuiver water.
* De dichtheid van de oplossing neemt ook toe in vergelijking met zuiver water.
4. Geen chemische reactie:
* Belangrijk is dat het mengen van zout en water niet resulteert in een chemische reactie . Het zout lost eenvoudig op en breekt af in zijn samenstellende ionen.
Samenvattend: Het mengen van zout en gedestilleerd water resulteert in een homogene oplossing waarbij het zout wordt opgelost, waardoor een elektrolytoplossing wordt gevormd met veranderde fysische eigenschappen.
 Wat als iedereen op aarde dezelfde taal sprak?
Wat als iedereen op aarde dezelfde taal sprak?  Zwarte koolstof varieert, maar hardnekkig volhardt, in sneeuw en ijs over de hele wereld
Zwarte koolstof varieert, maar hardnekkig volhardt, in sneeuw en ijs over de hele wereld Pitt-onderzoekers rapporteren push voor regionale groene infrastructuurdatabase
Pitt-onderzoekers rapporteren push voor regionale groene infrastructuurdatabase Wetenschappers verbeteren het model van door aardverschuivingen veroorzaakte tsunami
Wetenschappers verbeteren het model van door aardverschuivingen veroorzaakte tsunami Kunnen kleurgecodeerde bacteriën olielozingen helpen opsporen?
Kunnen kleurgecodeerde bacteriën olielozingen helpen opsporen?
Hoofdlijnen
- Wat u moet weten over mitose voor een test
- Wat doet oligosacharide-eiwittransferase?
- Hoe een cellenvorm zijn functie beïnvloedt
- De rol van microfilamenten in cytokinese
- Onderzoekers beoordelen hoe de kwaliteit van rode zee-egelkuit (uni) het gedrag van vissers beïnvloedt
- Waarom zijn er geen Eenhoorns?
- Onderzoekers ontdekken hoe ze celsignalerende moleculen als doelwitten in kaart kunnen brengen
- Superbug-onderzoek onthult hoe de E. coli-stam dodelijke krachten verwierf
- Celmembranen worden gekenmerkt door de aanwezigheid van?
- Automatisch en flexibel spaakwielen produceren uit composietmaterialen

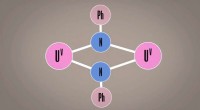
- Uranium ter vervanging van plastic? Doorbraak in de chemie kan de weg vrijmaken voor nieuwe materialen
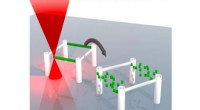
- Uitwisbare inkt voor 3D-printen
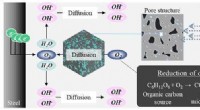
- Corrosiebestendigheid van stalen staven in beton bij vermenging met aerobe micro-organismen
- Gigantische doorbraak in flexo-elektriciteit in zachte elastomeren maakt de weg vrij voor verbeterde robots en zelfaangedreven pacemakers

 ColorUNet:een nieuwe diepe CNN-classificatiebenadering van inkleuring
ColorUNet:een nieuwe diepe CNN-classificatiebenadering van inkleuring Theorie ontmoet toepassing:Machine learning-technieken voor geothermische exploratie
Theorie ontmoet toepassing:Machine learning-technieken voor geothermische exploratie Meer diversiteit nodig in oliepalmplantages
Meer diversiteit nodig in oliepalmplantages Wetenschappers doen contra-intuïtieve waarnemingen in hybride kwantumsystemen
Wetenschappers doen contra-intuïtieve waarnemingen in hybride kwantumsystemen Nanofabrieken:bacteriële infecties stoppen zonder antibiotica
Nanofabrieken:bacteriële infecties stoppen zonder antibiotica Beving schudt West-Indonesië; geen onmiddellijke meldingen van schade
Beving schudt West-Indonesië; geen onmiddellijke meldingen van schade Wat heeft de volgende zuiver water, geconcentreerde suikeroplossing, natriumhydroxide, maagsap met de laagste pH?
Wat heeft de volgende zuiver water, geconcentreerde suikeroplossing, natriumhydroxide, maagsap met de laagste pH?  Doorbraak verbetert de prestaties van natrium-zwavelbatterijen
Doorbraak verbetert de prestaties van natrium-zwavelbatterijen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

