
Wetenschap
Zijn chemische eigenschappen van zuurstof meer vergelijkbaar met zwavel of fluor?
* Groepsrelatie: Zuurstof en zwavel zijn beide in groep 16 (via) van de periodieke tabel, bekend als de chalcogenen. Elementen binnen dezelfde groep delen vergelijkbare chemische eigenschappen vanwege hetzelfde aantal valentie -elektronen. Fluor, daarentegen, bevindt zich in groep 17 (VIIA), de halogenen.
* elektronegativiteit: Hoewel zowel zuurstof als fluor zeer elektronegatief zijn, is de elektronegativiteit van zwavel dichter bij die van Oxygen. Dit betekent dat zowel zuurstof als zwavel de neiging hebben elektronen te krijgen in chemische reacties, waardoor negatieve ionen (anionen) worden gevormd. Fluor, het meest elektronegatieve element, heeft een veel hogere elektronegativiteit.
* Oxidatie stelt: Zowel zuurstof als zwavel kunnen een reeks oxidatietoestanden vertonen, waaronder -2, +2, +4 en +6. Fluor daarentegen bestaat bijna altijd in een -1 oxidatietoestand.
* Samengestelde vorming: Zuurstof en zwavel vormen vergelijkbare soorten verbindingen, zoals oxiden en sulfiden. Zowel zuurstof als zwavel kunnen bijvoorbeeld verbindingen vormen met metalen, zoals natriumoxide (Na₂O) en natriumsulfide (NA₂S).
Samenvattend: Hoewel zowel zuurstof als fluor niet -metalen zijn, geven hun positie in de periodieke tabel en hun elektronegativiteitswaarden aan dat zuurstof meer vergelijkbare chemische eigenschappen deelt met zwavel dan fluor.
 Lost een koel oplosmiddel minder opgeloste stoffen op dan een gelijke hoeveelheid warm oplosmiddel?
Lost een koel oplosmiddel minder opgeloste stoffen op dan een gelijke hoeveelheid warm oplosmiddel?  Wat is de vorm en bindingshoek van natriumsulfaat?
Wat is de vorm en bindingshoek van natriumsulfaat?  Welke glycerol? 6 toepassingen voor de Wonder Compound
Welke glycerol? 6 toepassingen voor de Wonder Compound  Hoe verschillen Tstatehe -moleculen in elke toestand?
Hoe verschillen Tstatehe -moleculen in elke toestand?  Is een aldehyde verzadigd of onverzadigd?
Is een aldehyde verzadigd of onverzadigd?
 Welke levende dingen kun je in een boom vinden?
Welke levende dingen kun je in een boom vinden?  Tijd, plaats en hoe hout wordt gebruikt zijn factoren in de koolstofemissies als gevolg van ontbossing
Tijd, plaats en hoe hout wordt gebruikt zijn factoren in de koolstofemissies als gevolg van ontbossing  Waarom sommige kelpbossen in British Columbia meer gevaar lopen dan andere
Waarom sommige kelpbossen in British Columbia meer gevaar lopen dan andere  Marseille sluit enkele stranden om te zwemmen vanwege zorgen over vervuiling
Marseille sluit enkele stranden om te zwemmen vanwege zorgen over vervuiling Methaanknabbelende bacteriën zijn actiever in de zomer
Methaanknabbelende bacteriën zijn actiever in de zomer
Hoofdlijnen
- Hoe verhoudt het aantal chromosomen zich in gameten en somatische cellen?
- Wat is een abiotische factor in een ecosysteem?
- Wat zorgt ervoor dat dingen biologisch worden afgebroken?
- Hoe worden chemische signalen door het celmembraan overgedragen?
- Tegelijkertijd inzoomen door tijd en ruimte met superresolutie om te begrijpen hoe cellen zich delen
- Pigment voor de kleur sepia werd oorspronkelijk verkregen van welk waterdier?
- Menselijk genoom DNA-sequentietypen
- Welke twee organellen zijn door endosymbiose onderdeel geworden van de eukaryote cel?
- Wat is een analogie voor dierencel met een computer?
- Chemische neus snuffelt kritische verschillen in DNA-structuren
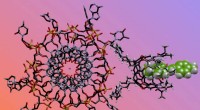
- Een zeer gevoelig en multi-analytisch systeem voor erfelijke nierziekte
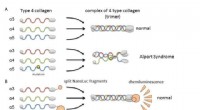
- Door ontwerp:van afval naar de volgende generatie koolstofvezel

- Linkse of rechtse moleculen helpen materiële structuren

- Machine-learning onderzoek ontsluit energiebesparende moleculaire kooien

 Welk landfilm scheidt stroomgebieden?
Welk landfilm scheidt stroomgebieden?  Leiders met empathie reageren slecht op het geven van negatieve feedback
Leiders met empathie reageren slecht op het geven van negatieve feedback Wie is oudere graniet of kalksteen?
Wie is oudere graniet of kalksteen?  Is Leonardo DiCaprio in totale eclips?
Is Leonardo DiCaprio in totale eclips?  Nieuwe buigbare smartphonetechnologie kan monitoring gebruiken om levens van patiënten te redden
Nieuwe buigbare smartphonetechnologie kan monitoring gebruiken om levens van patiënten te redden Hoe krijg je energie om te leven?
Hoe krijg je energie om te leven?  Meertraps vervormingsproces in legeringen met hoge entropie bij ultralage temperaturen onthuld
Meertraps vervormingsproces in legeringen met hoge entropie bij ultralage temperaturen onthuld Wat is Continental Glacier?
Wat is Continental Glacier?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

