
Wetenschap
Wat is de moleculaire formule van 284.77G Mol CCL?
* Empirische formule: De empirische formule vertelt u de eenvoudigste verhouding van het hele nummer van atomen in een verbinding. CCL vertelt ons dat er één koolstofatoom is voor elk chlooratoom.
* Moleculaire formule: De moleculaire formule toont het werkelijke aantal atomen van elk element in een molecuul.
Om de moleculaire formule te vinden, heb je het volgende nodig:
1. Molaire massa van de empirische formule: Bereken de molaire massa van CCL:
* Koolstof (c):12.01 g/mol
* Chloor (CL):35,45 g/mol
* Molaire massa van CCL:12.01 + 35.45 =47,46 g/mol
2. Verdeel de gegeven molaire massa door de empirische formule Molaire massa:
* 284.77 g/mol/47,46 g/mol =6
3. Vermenigvuldig de subscripts in de empirische formule met het resultaat:
* Ccl * 6 =c₆cl₆
Daarom is de moleculaire formule van de verbinding met een molaire massa van 284,77 g/mol en de empirische formule CCL is C₆cl₆.
Belangrijke opmerking: De moleculaire formule kan verschillen als de gegeven molaire massa niet nauwkeurig is of als er een fout is in de verstrekte empirische formule.
 Elektrostatische kracht neemt de leiding in bio-geïnspireerde polymeren
Elektrostatische kracht neemt de leiding in bio-geïnspireerde polymeren Hoeveel atomen LiBr zou je hebben als je begint met 1,25 mol. Wat is het antwoord en hoe kom je daaraan?
Hoeveel atomen LiBr zou je hebben als je begint met 1,25 mol. Wat is het antwoord en hoe kom je daaraan?  Verdubbeling van de efficiëntie van organische elektronica
Verdubbeling van de efficiëntie van organische elektronica Materiaalslijtage decoderen met supercomputers
Materiaalslijtage decoderen met supercomputers Extreem lage thermische geleidbaarheid in 1-D zachte kettingstructuur
Extreem lage thermische geleidbaarheid in 1-D zachte kettingstructuur
 Voorstanders van de Chesapeake Bay juichen de passage van de federale natuurbeschermingswet toe
Voorstanders van de Chesapeake Bay juichen de passage van de federale natuurbeschermingswet toe Chimpansee paring habits
Chimpansee paring habits Waarom natuurherstel tijd kost:schimmels kweken relaties
Waarom natuurherstel tijd kost:schimmels kweken relaties Wat zijn een primaire consument in grasland?
Wat zijn een primaire consument in grasland?  Minder werken om de planeet te redden? Hoe zorg je ervoor dat een vierdaagse werkweek daadwerkelijk de uitstoot vermindert?
Minder werken om de planeet te redden? Hoe zorg je ervoor dat een vierdaagse werkweek daadwerkelijk de uitstoot vermindert?
Hoofdlijnen
- Beschermde wateren bevorderen de heropleving van de westkust-zeebaars
- Jean-Baptiste Lamarck stelde voor dat organismen wat hebben?
- Welk type reproductie gebruiken de meeste planten?
- Wat is de definitie van hersenstam en cerebellum?
- Is het verschil tussen glycogeen en zetmeel?
- Wat is een rolachtige wetenschappelijke naam?
- Het woord strepto moet wanneer voor een bacterienaam worden geplaatst?
- Heeft een boom een kern?
- Spelt of zachte tarwe? Hun diversiteit aan voedingscomponenten verhindert de identificatie welke soort gezonder is
- Bananenschillen maken suikerkoekjes beter voor je

- Een ontbrekende schakel van methaan naar methanol blootleggen

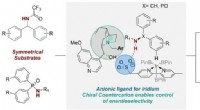
- Door metaal gekatalyseerde reacties die enantioselectief zijn gemaakt met behulp van chiraal kation
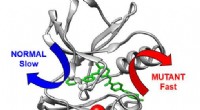
- Computersimulaties van eiwitten helpen te ontrafelen waarom resistentie tegen chemotherapie optreedt
- Onderzoekers herontdekken snelwerkend Duits insecticide dat verloren was gegaan in de nasleep van de Tweede Wereldoorlog

 Hoeveel atomen van elk element koolstof en waterstofzuurstof zijn er in het molecuul CH3O2OH?
Hoeveel atomen van elk element koolstof en waterstofzuurstof zijn er in het molecuul CH3O2OH?  Uitleg over een universum dat uit materie bestaat
Uitleg over een universum dat uit materie bestaat Een massa hangt aan een veer Welke krachten werken op de massa?
Een massa hangt aan een veer Welke krachten werken op de massa?  Bosduff moet worden overwogen bij gecontroleerde verbranding om schade aan bomen te voorkomen
Bosduff moet worden overwogen bij gecontroleerde verbranding om schade aan bomen te voorkomen 1 m² MTR is hoeveel inches?
1 m² MTR is hoeveel inches?  Mexico veilt zes van de negen grote diepwaterolieblokken
Mexico veilt zes van de negen grote diepwaterolieblokken NASA vindt sterk regenpotentieel in tropische storm Gordon
NASA vindt sterk regenpotentieel in tropische storm Gordon Oceaanplastic dat de kusten van Chili ooit verstikte, nu in hoeden van Patagonië
Oceaanplastic dat de kusten van Chili ooit verstikte, nu in hoeden van Patagonië
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

