
Wetenschap
Waarom vormt chloor een -1 ion?
* Elektronenconfiguratie: Chloor heeft 17 elektronen, met de volgende configuratie:2, 8, 7. Dit betekent dat het 7 elektronen heeft in de buitenste schaal, die de valentieschil wordt genoemd.
* octetregel: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een volledige buitenste schaal van 8 elektronen te bereiken (bekend als de octetregel). Deze configuratie wordt als stabiel en niet -reactief beschouwd.
* een elektron winnen: Chloor is een elektron dat weg is van een volledige buitenste schaal. Daarom is het energetisch gunstiger voor chloor om * één elektron te winnen om een negatief geladen ion (anion) te worden met een -1 -lading.
Het proces:
1. Een neutraal chlooratoom (CL) krijgt een elektron om een chloride-ion te worden (Cl-).
2. Dit maakt de buitenste schaal compleet met 8 elektronen, die de octetregel vervult.
3. De extra negatieve lading van het gewonnen elektron resulteert in de -1 -lading.
Samenvattend: Chloor vormt een -1 -ion omdat het verkrijgen van één elektron het mogelijk maakt om een stabiele elektronenconfiguratie te bereiken met een volledige buitenste schaal, volgens de octetregel.
 Hoe onderhoudt de aarde zijn magnetisch veld?
Hoe onderhoudt de aarde zijn magnetisch veld? Blikseminslag en subzichtbare ontladingen produceren moleculen die de atmosfeer zuiveren
Blikseminslag en subzichtbare ontladingen produceren moleculen die de atmosfeer zuiveren Onderzoekers bestuderen hoe klimaatverandering gewassen in India beïnvloedt
Onderzoekers bestuderen hoe klimaatverandering gewassen in India beïnvloedt Huizen en hoogbouw (en niets ertussenin):waarom landzonering niet effectief is geweest voor het verbeteren van de stedelijke dichtheid
Huizen en hoogbouw (en niets ertussenin):waarom landzonering niet effectief is geweest voor het verbeteren van de stedelijke dichtheid  Vermoedelijk brandstichting aangezien enorme Franse bosbranden opnieuw oplaaien
Vermoedelijk brandstichting aangezien enorme Franse bosbranden opnieuw oplaaien
Hoofdlijnen
- Op welke vier manieren verschilt meiose van mitose?
- Hoe adaptieve veranderingen in cellulaire vloeistoffen het zeeleven in staat stellen om te gaan met abiotische stressoren
- Onderzoek naar schapengenen kan helpen om gezondere dieren te fokken
- Het gebied van een lang bot waar lengtegroei optreedt, is het?
- Wat is een houtachtig weefsel van plant?
- Waardoor parasieten in het foodweb passen?
- Hoe dragen mensen bij aan zaadverspreiding?
- Wat zijn de externe kenmerken van geleedpotigen?
- Welke term verwijst naar organismen die worden gebruikt om de gezondheid van het milieu te bewaken?
- Onderzoekers ontwikkelen chemische reactiemethode voor efficiëntere medicijnproductie
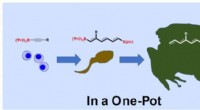
- Reparatie van kuilen milieuvriendelijk gemaakt met gruis van afvalwaterzuivering

- Ontworpen moleculen verwijderen selectief ongewenste ionen uit complexe oplossingen voor energieproductie

- Wetenschappers vragen:hoe kunnen vloeibare organellen in cellen naast elkaar bestaan zonder te versmelten?
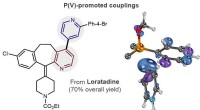
- Drugsjagers bewapenen, scheikundigen ontwerpen nieuwe reactie voor medicijnontdekking
 Hoeveel energie gebruikt een heel klein motorische motor?
Hoeveel energie gebruikt een heel klein motorische motor?  Astronomen vinden Jupiter-achtige wolkenbanden op de dichtstbijzijnde bruine dwerg
Astronomen vinden Jupiter-achtige wolkenbanden op de dichtstbijzijnde bruine dwerg Wat is sol in de chemie?
Wat is sol in de chemie?  Bij standaarddruk heeft een bepaalde verbinding een laag kookpunt en is het onoplosbaar in water STP dit waarschijnlijk bestaat als?
Bij standaarddruk heeft een bepaalde verbinding een laag kookpunt en is het onoplosbaar in water STP dit waarschijnlijk bestaat als?  Wat zijn de zonnetekens in de astrologie?
Wat zijn de zonnetekens in de astrologie?  Sterren en planeten zijn gemaakt van gassen in A?
Sterren en planeten zijn gemaakt van gassen in A?  Waarom komt landbries voor?
Waarom komt landbries voor?  Hong Kong nog steeds duurste stad voor expats:Mercer
Hong Kong nog steeds duurste stad voor expats:Mercer
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

