
Wetenschap
Welke bindingen zijn de laatste die breken wanneer een enzym wordt verwarmd 1 Disulfide 2 waterstof 3 Hydrofobe interacties 4 ionisch?
* disulfide -bindingen zijn het sterkste type binding dat betrokken is bij de eiwitstructuur. Het zijn covalente bindingen gevormd tussen de zwavelatomen van cysteïneresten. Deze bindingen zijn zeer stabiel en vereisen aanzienlijke energie om te breken.
* Waterstofbindingen zijn zwakker dan disulfidebindingen, maar nog steeds belangrijk voor eiwitstructuur. Ze vormen zich tussen poolgroepen in het eiwit.
* Hydrofobe interacties zijn het zwakste type binding dat betrokken is bij eiwitstructuur. Ze komen voort uit de neiging van niet -polaire zijketens om samen te clusteren, waardoor contact met water wordt vermeden.
* ionische bindingen zijn sterker dan hydrofobe interacties maar zwakker dan waterstofbruggen. Ze vormen zich tussen tegengesteld geladen aminozuurzijketens.
Samenvattend:
Wanneer een enzym wordt verwarmd, breken de zwakste bindingen (hydrofobe interacties) eerst. Naarmate de temperatuur toeneemt, breken waterstofbindingen en ionische bindingen de sterkste binding (disulfidebindingen) breken. Dit proces wordt denaturation genoemd , waarbij het enzym zijn driedimensionale structuur en zijn functie verliest.
 Waterpeil Zee van Galilea laagste in eeuw
Waterpeil Zee van Galilea laagste in eeuw Zelfs een beperkte nucleaire oorlog zou miljoenen mensen verhongeren, onthult nieuwe studie
Zelfs een beperkte nucleaire oorlog zou miljoenen mensen verhongeren, onthult nieuwe studie Vulkaan Canarische Eilanden verwoest honderden gebouwen terwijl lava naar zee kruipt
Vulkaan Canarische Eilanden verwoest honderden gebouwen terwijl lava naar zee kruipt Mars vulkaan, De dinosauriërs op aarde stierven ongeveer tegelijkertijd uit
Mars vulkaan, De dinosauriërs op aarde stierven ongeveer tegelijkertijd uit Het meten van de milieu-impact van een waterkrachtcentrale bij Inukjuak
Het meten van de milieu-impact van een waterkrachtcentrale bij Inukjuak
Hoofdlijnen
- Tegelijkertijd inzoomen door tijd en ruimte met superresolutie om te begrijpen hoe cellen zich delen
- Waarom hebben gameten 12 het aantal chromosomen nodig een gewone lichaamscel?
- Wat is syngamie?
- Welke massa omvat spieren vitale weefselsorganen en bot?
- Wat is de betekenis van dermale ostia in zoölogie?
- Welke orgel slaat een mix van afval en water op totdat het klaar is om het lichaam te verlaten?
- Welke organel is het meest prominent in cellen die grote hoeveelheden eiwitten maken?
- Wanneer vormden bacteriën?
- Welk enzym genereert ATP met behulp van de concentratiegradiënt van waterstofionen?
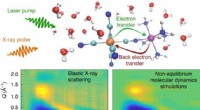
- Onderzoekers krijgen inzicht in hoe oplosmiddelmoleculen door licht gestuurde reacties beïnvloeden
- Zelfvoorzienende lus van chemische reacties kan een revolutie teweegbrengen in de productie van geneesmiddelen
- Welke dranken barsten van het umami-potentieel?

- Wetenschappers halen waterstofgas uit olie en bitumen, potentiële vervuilingsvrije energie geven

- Onderzoekers onthullen op oxygenaat gebaseerde routes bij de omzetting van syngas via bifunctionele oxide-zeolietkatalysatoren

 Welke waarden laden de load onmiddellijke 20 instructies in de accumulator?
Welke waarden laden de load onmiddellijke 20 instructies in de accumulator?  Wetenschappers berekenen stralingsdosis in botresten van slachtoffer bomaanslag Hiroshima
Wetenschappers berekenen stralingsdosis in botresten van slachtoffer bomaanslag Hiroshima Hoe mensen hebben gedomineerd en verstoord met het enten van planten?
Hoe mensen hebben gedomineerd en verstoord met het enten van planten?  Hoe begint de bodemvorming?
Hoe begint de bodemvorming?  Waarom sedimentaire rotsen gevonden als fineer?
Waarom sedimentaire rotsen gevonden als fineer?  Wat je van de maan ziet, hangt af van hoeveel zonovergoten zijkant met de aarde?
Wat je van de maan ziet, hangt af van hoeveel zonovergoten zijkant met de aarde?  Wil je daar groen bij?
Wil je daar groen bij?  Audit bekritiseert veiligheid Amerikaans toezicht op Southwest Airlines
Audit bekritiseert veiligheid Amerikaans toezicht op Southwest Airlines
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

