
Wetenschap
Wat is een evenwichtige vergelijking voor de reactie van zoutzuur en ammoniakoplossing?
HCl (aq) + nH₃ (aq) → nH₄cl (aq)
Dit is wat er gebeurt:
* zoutzuur (HCl) is een sterk zuur, wat betekent dat het volledig ioniseert in water om waterstofionen (H⁺) en chloride -ionen (CL⁻) te vormen.
* ammoniak (NH₃) is een zwakke basis, wat betekent dat het slechts gedeeltelijk in water ioniseert om ammoniumionen (NH₄⁺) en hydroxide -ionen te vormen (OH⁻).
Wanneer HCl en NH₃ reageren, reageren de waterstofionen van het zuur met de ammoniakmoleculen om ammoniumionen (NH₄⁺) te vormen . De chloride -ionen van het zuur en de ammoniumionen combineren om ammoniumchloride (NH₄CL) te vormen , die in de oplossing is opgelost.
De reactie is een zuur-base neutralisatiereactie , waarbij het zuur en de basis reageren op een zout (NH₄CL) en water (H₂o). In dit geval, omdat ammoniak een zwakke basis is, produceert de reactie geen aanzienlijke hoeveelheid water, maar vormt het wel het ammoniumzout.
 NASA-NOAA's Suomi NPP-satelliet had 3 banen nodig om Super Typhoon Hagibis te zien
NASA-NOAA's Suomi NPP-satelliet had 3 banen nodig om Super Typhoon Hagibis te zien Wat voor soort bomen worden gevonden in het boreale bos?
Wat voor soort bomen worden gevonden in het boreale bos?  Elke ademhaling die je neemt:het traject volgen van de vervuiling door ingeademde plasticdeeltjes
Elke ademhaling die je neemt:het traject volgen van de vervuiling door ingeademde plasticdeeltjes  Mobiele telefoon-app levert nauwkeurige regenvalinformatie aan het publiek
Mobiele telefoon-app levert nauwkeurige regenvalinformatie aan het publiek Een derde van de recente wereldwijde methaantoename komt uit tropisch Afrika
Een derde van de recente wereldwijde methaantoename komt uit tropisch Afrika
Hoofdlijnen
- Als t het allel voor hoge erwtenplanten vertegenwoordigt en T short Wat is fenotype van elke ouder nakomelingen?
- Het vastleggen van extracellulaire blaasjes:een nieuwe technologie voor het isoleren van ziektemarkers
- Wat zijn enkele voorbeelden van homeostase in de huid?
- Hoe kunnen we het gebruik van pesticiden terugdringen en boeren tegelijk empoweren? Een genuanceerder aanpak zou kunnen helpen
- Wat is H en O -antigenen?
- Zijn planten die Cross Pollinate Called Offspring?
- Wetenschappers onthullen eiwitstructuur die cruciaal is voor genexpressie
- Welk type chemische boodschapper stimuleert de cel die deze oorspronkelijk heeft uitgescheiden?
- Tandwortelpulp wordt een rijke bron van stamcellen
- Wetenschappers stellen nieuwe ladingsscheidingsstrategie voor in ferro-elektrische fotokatalysatoren
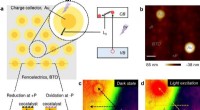
- Ingenieurs lossen mysterie op van de relatie tussen structuur en eigenschappen in katalysatoren voor emissiebeheersing
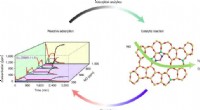
- Nauwkeurige en efficiënte dynamische rekenstrategie voor heterogene katalyse
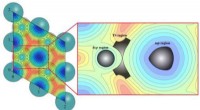
- Lenen van de natuur om de kracht van de zon aan te boren

- Ontwerpen van hiërarchische nanoporeuze membranen voor zeer efficiënte adsorptie- en opslagtoepassingen

 Huiselijk geweld en wapenverkoop in de tijd van COVID-19
Huiselijk geweld en wapenverkoop in de tijd van COVID-19 Synthese van biobased high-performance polyamide uit biogene residuen
Synthese van biobased high-performance polyamide uit biogene residuen Wat zijn de 9 hoofdnamen van Stars Leo Constellation?
Wat zijn de 9 hoofdnamen van Stars Leo Constellation?  Wat zijn de belangrijkste lagen in volwassen bodems?
Wat zijn de belangrijkste lagen in volwassen bodems?  Een Solar Mass Star zal wanneer evolueren van de hoofdreeks wanneer?
Een Solar Mass Star zal wanneer evolueren van de hoofdreeks wanneer?  Waar is de zonpositie om 12.00 uur in de lucht?
Waar is de zonpositie om 12.00 uur in de lucht?  Wat betekent puur dominant?
Wat betekent puur dominant?  Nieuwe mobiele app kan helpen om seksueel geweld in Kenia te verminderen
Nieuwe mobiele app kan helpen om seksueel geweld in Kenia te verminderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

