
Wetenschap
Wat is volledige neutralisatie van hypofosforzuur met natriumhydroxide?
Hier is de evenwichtige chemische vergelijking:
H₃po₂ (aq) + 2naOH (aq) → nah₂po₂ (aq) + 2h₂o (l)
Verklaring:
* Hypofosforzuur (H₃po₂) is een zwak monoprotisch zuur, wat betekent dat het slechts één proton (H⁺) per molecuul kan doneren.
* Natriumhydroxide (NaOH) is een sterke basis, die gemakkelijk dissocieert in natriumionen (Na⁺) en hydroxide -ionen (OH⁻) in oplossing.
* Tijdens neutralisatie reageren de hydroxide -ionen van NaOH met de waterstofionen van H₃po₂, wat water vormt (H₂o).
* De resterende natriumionen (Na⁺) combineren met het hypofosfietion (H₂po₂⁻) om natriumhypofosfiet te vormen (nah₂po₂).
Sleutelpunten:
* De reactie is een zuur-base neutralisatiereactie.
* De producten zijn een zout (natriumhypofosfiet) en water.
* De reactie is exotherme en laat warmte vrij.
Opmerking: De volledige neutralisatie treedt op wanneer de mol NaOH toegevoegd is gelijk aan tweemaal de mol H₃po₂ aanwezig. Dit zorgt ervoor dat alle zure protonen van de H₃PO₂ worden geneutraliseerd door de hydroxide -ionen.
 Waarom wordt Germanium geplaatst in groep 14 en periode 4 van de periodiek systeem?
Waarom wordt Germanium geplaatst in groep 14 en periode 4 van de periodiek systeem?  Het suikermetabolisme is verrassend conventioneel bij kanker
Het suikermetabolisme is verrassend conventioneel bij kanker Wijn met een dubbele shot vitamine C?
Wijn met een dubbele shot vitamine C?  Chemische reactie van krijt en natriumcarbonaat?
Chemische reactie van krijt en natriumcarbonaat?  Een voorbeeld van plasmonen die rechtstreeks invloed hebben op moleculen
Een voorbeeld van plasmonen die rechtstreeks invloed hebben op moleculen
 Hoe te beginnen Zoetwater Garnalen Farming
Hoe te beginnen Zoetwater Garnalen Farming Hoe Morel-paddestoelen te jagen in Indiana
Hoe Morel-paddestoelen te jagen in Indiana Magnitude 6.9 aardbeving slaat toe voor de kust van Alaska
Magnitude 6.9 aardbeving slaat toe voor de kust van Alaska Arctische stoofpot:begrijpen hoe meren op hoge breedtegraden reageren op en invloed hebben op de klimaatverandering
Arctische stoofpot:begrijpen hoe meren op hoge breedtegraden reageren op en invloed hebben op de klimaatverandering  Hier is wat Youd echt ziet als je de Noordpool bezoekt
Hier is wat Youd echt ziet als je de Noordpool bezoekt
Hoofdlijnen
- Waarom worden ze lagere dieren genoemd?
- Wat voor soort wetenschapper die dingen in groepen plaatst?
- Waar kwam de wetenschappelijke naam van konijn vandaan?
- Wat zijn enkele vragen die wetenschappers nog hebben over endosymbiose?
- Hoe een mutatie in het SKD3-enzym de MGCA7-ziekte kan veroorzaken
- Wat zijn de spoelen van DNA in de kern?
- De organen zijn gespecialiseerd en gemaakt van weefsel gevormd door groepencellen Wat vormt het hart?
- Hoe heeft technologie de manier veranderd waarop biologen levende wezens bestuderen, om een voorbeeld te geven?
- In de stad levende pimpelmezen kunnen grotere eieren leggen vanwege wat ze eten
- Water was een winnaar in het opvangen van koolstofdioxide

- De kans op succes in de synthetische chemie vergroten
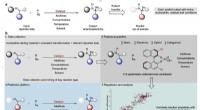
- Bacteriële enzymen gekaapt om complexe moleculen te maken die normaal door planten worden gemaakt
- Biologisch afbreekbare glitter en vervuilende microalgen:de nieuwe materialen geïnspireerd door de natuur

- Interactieve kwantumchemie in virtual reality

 Groenlands groeiende ijsplaten intensiveren de afvoer van smeltwater naar de oceaan
Groenlands groeiende ijsplaten intensiveren de afvoer van smeltwater naar de oceaan Hoe bedrijven hun ecologische voetafdruk berekenen
Hoe bedrijven hun ecologische voetafdruk berekenen  Welke mineralen bruisen als er zoutzuur op de mineralen valt?
Welke mineralen bruisen als er zoutzuur op de mineralen valt?  Welke materialen zijn er in rode zakken met bio-gevaar?
Welke materialen zijn er in rode zakken met bio-gevaar?  Een plasma is een oververhit blanco?
Een plasma is een oververhit blanco?  Onderzoekers ontwikkelen nieuwe manier om de milieu-impact van ammoniakproductie te berekenen
Onderzoekers ontwikkelen nieuwe manier om de milieu-impact van ammoniakproductie te berekenen De levenscyclus van de Stonefly
De levenscyclus van de Stonefly  Wat is neurotransmitter en geef voorbeelden?
Wat is neurotransmitter en geef voorbeelden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

