
Wetenschap
Hoeveel mol voor zilverchloride worden geproduceerd uit 7 mol nitraat?
* We hebben de volledige chemische reactie nodig. Het aantal geproduceerde mol zilverchloride hangt af van de specifieke reactie met nitraat. Bijvoorbeeld:
* Reactie 1: Agno₃ (zilvernitraat) + NaCl (natriumchloride) → AgCl (zilverchloride) + nano₃ (natriumnitraat)
* Reactie 2: 2 Agno₃ (zilvernitraat) + CACL₂ (calciumchloride) → 2 agcl (zilverchloride) + Ca (No₃) ₂ (calciumnitraat)
* We moeten de beperkende reactant kennen. De hoeveelheid gevormde product wordt bepaald door de reactant die eerst oploopt.
Hier is hoe u het probleem kunt oplossen zodra u de volledige reactie hebt:
1. Breng de chemische vergelijking in evenwicht: Zorg ervoor dat het aantal atomen van elk element hetzelfde is aan beide zijden van de vergelijking.
2. Identificeer de molverhouding: De gebalanceerde vergelijking toont de verhouding van mol nitraat tot mol zilverchloride geproduceerd.
3. Bereken mol zilverchloride: Vermenigvuldig de mol nitraat met de molverhouding van stap 2.
Voorbeeld:
Laten we de eerste reactie hierboven gebruiken:
Agno₃ + NaCl → Agcl + nano₃
1. uitgebalanceerd: De vergelijking is al in evenwicht.
2. Mol -verhouding: De verhouding is 1 mol Agno₃ tot 1 mol AGCL.
3. Bereken mol AgCl: Als u 7 mol Agno₃ hebt, produceert u 7 mol AGCL (omdat de verhouding 1:1 is).
Geef de volledige chemische reactie op, zodat ik u een specifiek antwoord kan geven!
 Wat zijn het gebruik van uitbreiding in vaste stoffen?
Wat zijn het gebruik van uitbreiding in vaste stoffen?  Wat is het witte spul op mijn paaschocolade, en kan ik het nog steeds eten?
Wat is het witte spul op mijn paaschocolade, en kan ik het nog steeds eten? Waarom is het bruisen en schuimen van een fysische chemische verandering?
Waarom is het bruisen en schuimen van een fysische chemische verandering?  Chemie gebruiken om het verschil tussen koude en warme koffie te ontdekken
Chemie gebruiken om het verschil tussen koude en warme koffie te ontdekken Systematische studie lost discussie over katalysatorontwerp voor uitlaatgassen van auto's op
Systematische studie lost discussie over katalysatorontwerp voor uitlaatgassen van auto's op
 In de harde hoek van Oeganda, herders vechten tegen klimaatverandering
In de harde hoek van Oeganda, herders vechten tegen klimaatverandering Wat is principe?
Wat is principe?  Vraag en antwoord:landschapsecoloog zegt dat bosbranden in Californië geen willekeurige situatie zijn
Vraag en antwoord:landschapsecoloog zegt dat bosbranden in Californië geen willekeurige situatie zijn De toekomst van ruimtekolonisatie:terraforming of habitats?
De toekomst van ruimtekolonisatie:terraforming of habitats?  Boek beschrijft vier belangrijke facetten van de Green New Deal en waarom ze werkelijkheid kunnen worden
Boek beschrijft vier belangrijke facetten van de Green New Deal en waarom ze werkelijkheid kunnen worden
Hoofdlijnen
- Waar krijgen organismen hun DNA?
- Waar wordt voedsel opgeslagen in een boom?
- Herwilder de bodem:het grootste stedelijke herwilderingsproject gaat ondergronds
- Ladderlopende sprinkhanen laten zien dat grote hersenen niet altijd de beste zijn
- Wat boeren denken over genetisch gemodificeerde gewassen
- Wetenschappers laten zien hoe bacterieel 'aanvalshond'-toxine de eiwitsynthese verstoort
- Katten doden een miljoen vogels per dag in Australië
- Katabole en anabole routes zijn vaak gekoppeld in de cel, omdat?
- Moleculaire tags onthullen hoe beschadigde lysosomen worden geselecteerd en gemarkeerd voor verwijdering
- Het doorbreken van de mal:een ongebruikelijke materiaalkeuze levert batterijen met een ongelooflijk lange levensduur op

- Opheldering van trillingsenergie van een enkel molecuul in een extern krachtveld
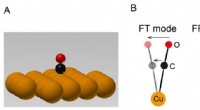
- Alternatief voor stikstof:Zuurstofplasma kan de eigenschappen van elektrodematerialen verbeteren
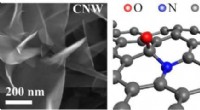
- Enig licht schijnen op een obscuur proteoom
- Fotokracht voor microlabs

 Heeft Chromite er ijzer in?
Heeft Chromite er ijzer in?  Wat bevindt zich op 38 graden noord en 90 west?
Wat bevindt zich op 38 graden noord en 90 west?  Wat zijn complexe bergen?
Wat zijn complexe bergen?  Hoe wordt het metalen natrium opgeslagen?
Hoe wordt het metalen natrium opgeslagen?  Welke functie is om energie te maken en de vorm van een ovaal?
Welke functie is om energie te maken en de vorm van een ovaal?  Welke voortdurende opvallende beweging in de gewenste richting na contact met het object?
Welke voortdurende opvallende beweging in de gewenste richting na contact met het object?  Maakt het klimaat deel uit van een geografie?
Maakt het klimaat deel uit van een geografie?  Nano-hashtags kunnen definitief bewijs leveren van Majorana-deeltjes
Nano-hashtags kunnen definitief bewijs leveren van Majorana-deeltjes
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

