
Wetenschap
Waarom combineert zilvernitraat eerst met chloride -ionen in water en geen kaliumdichromaat?
Dit is waarom dit gebeurt:
* Regels voor oplosbaarheid: Over het algemeen zijn chloridezouten oplosbaar, behalve die met zilver (Ag⁺), lood (PB²⁺) en Mercury (I) (Hg₂²⁺). Dit betekent dat zilverchloride een vast neerslag vormt wanneer zilverionen (Ag⁺) uit zilvernitraatchloride -ionen (CL⁻) in oplossing ontmoet.
* Reaction Equilibrium: De reactie tussen zilvernitraat en chloride -ionen vormt een neerslag omdat het evenwicht sterk de vorming van vast zilverchloride bevordert. Dit komt door de sterke aantrekkingskracht tussen de zilver- en chloride -ionen, die leidt tot de vorming van een stabiele, onoplosbare roosterstructuur.
* Oplosbaarheid van kaliumdichromaat: Kaliumdichromaat is daarentegen een oplosbare verbinding. Het dissocieert in kaliumionen (k⁺) en dichromaationen (cr₂o₇²⁻) in water, die in oplossing blijven.
Samenvattend: Zilvernitraat reageert bij voorkeur met chloride -ionen omdat de vorming van het onoplosbare zilverchloride -neerslag de reactie op voltooiing drijft. Kaliumdichromaat, oplosbaar, vormt geen neerslag en concurreert daarom niet met de vorming van de zilveren chloride.
 Een computermodel legt de ongrijpbare overgangstoestanden van chemische reacties vast
Een computermodel legt de ongrijpbare overgangstoestanden van chemische reacties vast  Nieuw apparaat identificeert bloeddonoren van hoge kwaliteit
Nieuw apparaat identificeert bloeddonoren van hoge kwaliteit Hoe ontwikkelt een atoom een lading?
Hoe ontwikkelt een atoom een lading?  Moleculen in lichaam beter zichtbaar in nieuw detectiesysteem zeggen wetenschappers
Moleculen in lichaam beter zichtbaar in nieuw detectiesysteem zeggen wetenschappers Wat hebben Berkelium en Uranium gemeen?
Wat hebben Berkelium en Uranium gemeen?
 NASA vindt een met wolken gevuld oog in de tropische cycloon Gaja
NASA vindt een met wolken gevuld oog in de tropische cycloon Gaja Australië begint op lange termijn naar herstel als het water zich terugtrekt
Australië begint op lange termijn naar herstel als het water zich terugtrekt Dit is hoe de klimaatcrisis de watercyclus beïnvloedt
Dit is hoe de klimaatcrisis de watercyclus beïnvloedt  Oude Maya-huizen laten zien dat ongelijkheid in rijkdom verbonden is met despotisch bestuur
Oude Maya-huizen laten zien dat ongelijkheid in rijkdom verbonden is met despotisch bestuur  Herstel Amazones van bosverlies beperkt door klimaatverandering
Herstel Amazones van bosverlies beperkt door klimaatverandering
Hoofdlijnen
- Wetenschappers ontwikkelen nieuwe techniek om het verborgen genoom te onthullen
- Wat specificeert elk codon in mRNA?
- Kunnen data dolfijnen redden? Hoe wetenschappers NASA-gegevens gebruiken om het verband tussen zonnestormen en het stranden van dieren te bestuderen
- Welke indicatoren worden gebruikt voor elk molecuul eenvoudige suikers zetmeel lipiden eiwitten?
- Is het waar dat de gametophyt -fase dominant is in een levenscyclus?
- Een lid van de sporozoa -groepsprotisten is?
- Wat betekent variabele in een wetenschappelijke methode?
- Welke 2 dingen worden gevonden in een plantencel maar geen menselijke cel?
- Wat is de functie van een embryo in een zaadje?
- Zuurstofreducerende enzymen begrijpen

- Chemici synthetiseren een antimicrobiële verbinding uit onschadelijke chitine en selenium
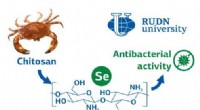
- Kooldioxide omzetten in koolmonoxide met behulp van water, elektriciteit

- Legerwetenschappers ontdekken kracht in urine

- Eenvoudig te monteren steigers van gouden nanodeeltjes dienen als moleculaire sonde
 Hoe ziet een ruimtesatelliet eruit?
Hoe ziet een ruimtesatelliet eruit?  Windenergie en dodelijke vleermuizen:hoe het verbeteren van akoestische monitoring de biodiversiteit kan beschermen
Windenergie en dodelijke vleermuizen:hoe het verbeteren van akoestische monitoring de biodiversiteit kan beschermen  Hybride auto's te stil voor de veiligheid van voetgangers? Voeg daar nog motorgeluid aan toe, zeggen onderzoekers op het gebied van menselijke factoren
Hybride auto's te stil voor de veiligheid van voetgangers? Voeg daar nog motorgeluid aan toe, zeggen onderzoekers op het gebied van menselijke factoren  Wanneer circulair plasmide-DNA op een enkele plaats wordt opengesneden door restrictie-enzym, is het resulterende stuk?
Wanneer circulair plasmide-DNA op een enkele plaats wordt opengesneden door restrictie-enzym, is het resulterende stuk?  NASA stelt deep-space Orion-test uit tot 2019 vanwege kosten
NASA stelt deep-space Orion-test uit tot 2019 vanwege kosten Waarom schattigheid wint van behoeftigheid bij het doen van liefdadigheidsdonaties
Waarom schattigheid wint van behoeftigheid bij het doen van liefdadigheidsdonaties Welk element heeft de laagste elektronenaffiniteit? Is het stikstof?
Welk element heeft de laagste elektronenaffiniteit? Is het stikstof?  Standpunt:Subsidies voor fossiele brandstoffen kosten de Canadezen veel meer geld dan de CO2-belasting
Standpunt:Subsidies voor fossiele brandstoffen kosten de Canadezen veel meer geld dan de CO2-belasting
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

