
Wetenschap
Wat is de volledige ionische vergelijking voor lood II nitraat en natriumsulfaat?
1. Schrijf de gebalanceerde moleculaire vergelijking:
Pb (no₃) ₂ (aq) + na₂so₄ (aq) → pbso₄ (s) + 2nano₃ (aq)
2. Identificeer de oplosbare ionische verbindingen:
* Lood (ii) nitraat (PB (no₃) ₂) is oplosbaar in water.
* Natriumsulfaat (Na₂so₄) is oplosbaar in water.
* Lood (II) sulfaat (PBSO₄) is onoplosbaar in water (het vormt een neerslag).
* Natriumnitraat (nano₃) is oplosbaar in water.
3. Scheid de oplosbare ionische verbindingen in hun ionen:
* Pb (no₃) ₂ (aq) → pb²⁺ (aq) + 2no₃⁻ (aq)
* Na₂so₄ (aq) → 2na⁺ (aq) + so₄²⁻ (aq)
* PBSO₄ (s) blijft als een vaste stof.
* 2nano₃ (aq) → 2na⁺ (aq) + 2no₃⁻ (aq)
4. Combineer de ionen om de volledige ionische vergelijking te vormen:
Pb²⁺ (aq) + 2no₃⁻ (aq) + 2na⁺ (aq) + so₄²⁻ (aq) → pbso₄ (s) + 2na⁺ (aq) + 2no₃⁻ (aq)
Dit is de volledige ionische vergelijking.
 Waarom vervangen niet -metalen waterstof niet van zuren?
Waarom vervangen niet -metalen waterstof niet van zuren?  Bereken Isotoniciteit
Bereken Isotoniciteit Wat is de regel bij het benoemen van ionische verbindingen met variabele oxidatiegetallen?
Wat is de regel bij het benoemen van ionische verbindingen met variabele oxidatiegetallen?  Schrijf een procedure voor het onderscheid tussen zuurstofgas en kooldioxidegas?
Schrijf een procedure voor het onderscheid tussen zuurstofgas en kooldioxidegas?  Programmeerbare druppelmanipulatie door een robot met magnetische activering
Programmeerbare druppelmanipulatie door een robot met magnetische activering
 NOAA vindt Tropical Storm Ericks-centrum met behulp van twee NASA-satellieten
NOAA vindt Tropical Storm Ericks-centrum met behulp van twee NASA-satellieten Klimaatverandering maakt zomerweer stormachtiger en toch meer stagnerend
Klimaatverandering maakt zomerweer stormachtiger en toch meer stagnerend NASA's Aqua Satellite vindt een groot haveloos oog in tyfoon Krosa
NASA's Aqua Satellite vindt een groot haveloos oog in tyfoon Krosa Het uitgedroogde zuidwesten van de VS krijgt uitstel terwijl smeltende sneeuw rivieren vult
Het uitgedroogde zuidwesten van de VS krijgt uitstel terwijl smeltende sneeuw rivieren vult Krachtige orkaan Hawaï gedegradeerd tot tropische storm
Krachtige orkaan Hawaï gedegradeerd tot tropische storm
Hoofdlijnen
- Dolfijnen die zijn blootgesteld aan olie van Deepwater Horizon lekkage bleken veranderingen in genactiviteiten te hebben
- Heeft het woord wetenschapper er wetenschap in?
- Hoeveel signaalmethoden zijn er nodig om informatie te verzenden?
- Wat is de bundel van zenuwen die naar je hersenen leiden geroepen?
- Wat zijn natuurlijke recorces?
- Welke levensfunctie is direct gerelateerd aan diffusie en osmose?
- Welk jaar was het eerste DNA -model?
- De theorie verklaart waarom 25 procent van de culturen mannelijke geslachtsdelen afsnijdt
- Welke dieren doorloopt metamorfose?
- Waterdichte capsules voor doelgerichte toediening van medicijnen

- Neutronen onderzoeken biologische materialen voor inzicht in COVID-19-virusinfectie
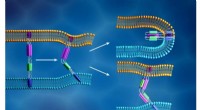
- Hightech oppervlakken kunnen de weerstand en CO2-uitstoot van schepen aanzienlijk verminderen

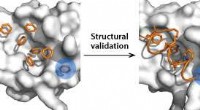
- Op benzeen gebaseerde sondes markeren twee verborgen bindingsplaatsen op een doelwit tegen kanker
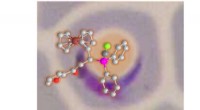
- Onderzoekers ontwikkelen met goud gecomplexeerde ferrocenylfosfines als krachtige antimalariamiddelen
 De stralingsmetingen van Fukushima zijn extreem hoog ... maar laten we niet in paniek raken
De stralingsmetingen van Fukushima zijn extreem hoog ... maar laten we niet in paniek raken  Uber zet beursgang in gang, probeert kansen te ontbranden
Uber zet beursgang in gang, probeert kansen te ontbranden Wat is de netto ionische vergelijking voor natriumsulfaat en bariumchloride wanneer deelname is gevormd?
Wat is de netto ionische vergelijking voor natriumsulfaat en bariumchloride wanneer deelname is gevormd?  Hoe dragen tsunami's bij aan erosie?
Hoe dragen tsunami's bij aan erosie?  Wat is de betekenis van het meteorietpatroon in het ontwerp van dit stuk?
Wat is de betekenis van het meteorietpatroon in het ontwerp van dit stuk?  Waar is het laatste land op aarde?
Waar is het laatste land op aarde?  NASA lanceert Raven om autonoom rendez-vous vermogen te ontwikkelen
NASA lanceert Raven om autonoom rendez-vous vermogen te ontwikkelen Egel aanpassing
Egel aanpassing
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

