
Wetenschap
Welke kleur is kopersulfaat op pH -schaal?
Dit is waarom:
* kopersulfaat is een zout: Het lost op in water om koperionen (Cu²⁺) en sulfaationen (SO₄²⁻) te vormen.
* pH is een maat voor de oplossing: De pH van de oplossing hangt af van de concentratie van waterstofionen (H⁺) en hydroxide -ionen (OH⁻) in het water, niet de kleur van het kopersulfaat zelf.
Dit is wat er kan gebeuren:
* waterige oplossingen van kopersulfaat zijn typisch zuur: Dit komt omdat koperionen kunnen reageren met watermoleculen om hydroniumionen (H₃o⁺) te vormen, die de zuurgraad van de oplossing verhogen. De pH zal afhangen van de concentratie kopersulfaat in de oplossing.
* kleurverandering met pH: Koperionen in oplossing kunnen verschillende kleuren vertonen, afhankelijk van de pH. In zure oplossingen zijn ze vaak blauw, maar naarmate de pH toeneemt, kunnen ze groenachtig of zelfs blauwachtig groen worden.
Dus, hoewel kopersulfaat zelf geen kleur op de pH -schaal heeft, kunnen de oplossingen zuur zijn en kleurveranderingen vertonen, afhankelijk van de pH.
 Hoe het oplossingsvermogen kan worden berekend
Hoe het oplossingsvermogen kan worden berekend
Osmose is een vitaal proces voor levende organismen. Het is het fenomeen waarbij water over een semi-permeabele barrière van de zijkant migreert met de minste concentratie opgeloste stoffen naar de zij
 Hoe de enorme wateroverdracht in China de drinkkwaliteit beïnvloedt
Hoe de enorme wateroverdracht in China de drinkkwaliteit beïnvloedt  Hoeveel elektronen verliest of wint lithium om een stabiele octetconfiguratie te bereiken?
Hoeveel elektronen verliest of wint lithium om een stabiele octetconfiguratie te bereiken?  Wat is formule voor koperwaterstofsulfaat?
Wat is formule voor koperwaterstofsulfaat?  Lijst met neutrofiele en acidofiele heterotrofe bacteriën
Lijst met neutrofiele en acidofiele heterotrofe bacteriën
 Waarom houden sommige mensen van wetenschap?
Waarom houden sommige mensen van wetenschap?  Papierrecycling moet worden aangedreven door hernieuwbare energiebronnen om het klimaat te redden
Papierrecycling moet worden aangedreven door hernieuwbare energiebronnen om het klimaat te redden Nederlanders sluiten EU's grootste gasveld vanwege aardbevingsgevaar
Nederlanders sluiten EU's grootste gasveld vanwege aardbevingsgevaar Natuurrampen vergroten de ongelijkheid. Herstelfinanciering kan de zaken erger maken
Natuurrampen vergroten de ongelijkheid. Herstelfinanciering kan de zaken erger maken Wetenschappers ontdekken overvloed aan plastic dat is opgebouwd in zee-ijs dat is verzameld in de noordwestelijke doorgang van het noordpoolgebied
Wetenschappers ontdekken overvloed aan plastic dat is opgebouwd in zee-ijs dat is verzameld in de noordwestelijke doorgang van het noordpoolgebied
Hoofdlijnen
- Hoe in een laboratorium gekweekte huid werkt
- Hoe kleine chromosomen met grote concurreren om de aandacht van een cel
- Zijn bacteriën een bron van restrictie -enzymen in DNA?
- Welke cellulaire organel wordt omgeven door een dubbel membraan bevat DNA en verantwoordelijk voor het omzetten van anorganische verbindingen in organisch met behulp van lichte energie?
- Waarom is het zo moeilijk voor soorten om hun ecologische niche te verlaten?
- Wat is belangrijk van het menselijk lichaamssysteem?
- Coevolution: definitie, soorten en voorbeelden
- Welke invloed heeft veroudering op de mogelijkheid om homeostase te herstellen?
- Het ribosoom interpreteert het mRNA om een reeks van te produceren?
- Wetenschappers bouwen allereerste synthetisch DNA-achtig polymeer
- Verpakkingsmaterialen recyclebaar maken

- Chemisch etende bacteriën verwijderen waarschijnlijk kankerverwekkend uit verontreinigd water

- Onderzoekers identificeren enzym dat verantwoordelijk is voor de verspreiding van kankertumoren

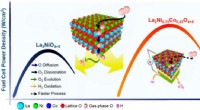
- Nieuw ontdekte ontwerpregels leiden tot betere brandstofcelkatalysator
 Pluto's 'Hulk-achtige' maan Charon:een mogelijke oude oceaan?
Pluto's 'Hulk-achtige' maan Charon:een mogelijke oude oceaan?  Stroom van klachten naar EU-landen sinds de invoering van de datawet
Stroom van klachten naar EU-landen sinds de invoering van de datawet Wat is een grasland met verspreid bos?
Wat is een grasland met verspreid bos?  De chemie van radium onderzoeken om kankerbehandelingen vooruit te helpen met behulp van ioniserende straling
De chemie van radium onderzoeken om kankerbehandelingen vooruit te helpen met behulp van ioniserende straling Klimaatcrisis kan frequentie van extreme regionale zomerdroogten in Europa verdubbelen
Klimaatcrisis kan frequentie van extreme regionale zomerdroogten in Europa verdubbelen 1,5 pond hoeveel gram?
1,5 pond hoeveel gram?  Waarom is er licht op een heldere nacht wanneer de volle maan?
Waarom is er licht op een heldere nacht wanneer de volle maan?  Hoe komt het gekleurde water in Pechay -bladeren?
Hoe komt het gekleurde water in Pechay -bladeren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

