
Wetenschap
Wanneer aluminiumfolie reageert met koper II -sulfaat, wat is het product?
2AL (s) + 3CUSO₄ (aq) → al₂ (So₄) ₃ (aq) + 3Cu (s)
Hier is een uitsplitsing van wat er gebeurt:
* aluminium (AL) is reactiever dan koper (Cu). Dit betekent dat aluminium een sterkere neiging heeft om elektronen te verliezen.
* koper (ii) sulfaat (cuso₄) is een oplosbaar zout, wat betekent dat het oplost in water om koper (II) ionen (Cu²⁺) en sulfaationen (SO₄²⁻) te vormen.
* De reactie is een enkele verplaatsingsreactie waarbij aluminium koper uit zijn oplossing verplaatst. Aluminiumatomen verliezen elektronen en vormen aluminiumionen (Al³⁺).
* koperionen (cu²⁺) Krijg elektronen en word vast koper (Cu) atomen, die uit de oplossing neerstorten.
* aluminiumsulfaat (Al₂ (So₄) ₃) wordt gevormd als een oplosbaar zout, dat in oplossing blijft.
in eenvoudiger termen:
De aluminiumfolie reageert met de koper (II) sulfaatoplossing, wat resulteert in:
* Vorming van solide koper Op de aluminiumfolie, waardoor het een roodbruine coating krijgt.
* aluminiumsulfaat Oplost in de oplossing.
U kunt deze reactie visueel observeren:
* De blauwe kleur van de koper (II) sulfaatoplossing vervaagt terwijl de koperionen worden verbruikt.
* De aluminiumfolie wordt bedekt met een roodbruine laag koper.
 Maken chemische reacties nieuwe materialen die de reactanten worden genoemd?
Maken chemische reacties nieuwe materialen die de reactanten worden genoemd?  Nieuwe inzichten in processen op moleculair niveau kunnen corrosie helpen voorkomen en de katalytische conversie verbeteren
Nieuwe inzichten in processen op moleculair niveau kunnen corrosie helpen voorkomen en de katalytische conversie verbeteren Chemical Engineering Research Paper Onderwerpen
Chemical Engineering Research Paper Onderwerpen  Onderzoekers tonen aan dat een kankerverdedigingsmechanisme kan worden teruggedraaid om tumoren aan te vallen
Onderzoekers tonen aan dat een kankerverdedigingsmechanisme kan worden teruggedraaid om tumoren aan te vallen Is heliumgas een pure stof of mengsel?
Is heliumgas een pure stof of mengsel?
 Onwaarschijnlijke bondgenoten duwen het Witte Huis om de vervuiling van de Tijuana-rivier terug te dringen
Onwaarschijnlijke bondgenoten duwen het Witte Huis om de vervuiling van de Tijuana-rivier terug te dringen Welke fysieke vorm van water is het meest aanwezig op aarde?
Welke fysieke vorm van water is het meest aanwezig op aarde?  Hoe de Antarctische Circumpolaire Stroom helpt om Antarctica bevroren te houden
Hoe de Antarctische Circumpolaire Stroom helpt om Antarctica bevroren te houden Koraalonderzoek onthult verrassende wending
Koraalonderzoek onthult verrassende wending Grassland Biome-feiten
Grassland Biome-feiten
Hoofdlijnen
- Studie kan strategieën opleveren om het goede cholesterol te verhogen
- Hoe voorspel je genetische overerving met behulp van eenvoudige overerving?
- Wat is de Disc-diffusiemethode die wordt gebruikt bij antibacteriële activiteit?
- Een garnalenverhaal - winnaars en verliezers in klimaatverandering
- Welke vroege vorm van een organisme waaruit latere vormen dalen?
- Hoeveel chromosomen hebben de mens in profase?
- Het verschil tussen het somatische en autonome systeem
- Wat is synaptische varicositeit die verwijst naar hoe veranderingen in sensibilisatie van Aplysia?
- Wat is het verschil in wetenschappelijke methode en een onwetenschappelijke methode?
- Draagbare elektronica voor continue cardiale, ademhalingsbewaking

- Hoe goede metalen slecht worden:ontdekking verklaart onverwachte eigenschappen van exotische metaalverbindingen

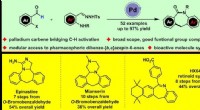
- Modulaire benadering van dibenzo-gefuseerde ε-lactams door middel van carbeen overbruggende CH-activering
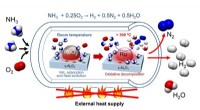
- Katalysator voor de koolstofvrije productie van waterstofgas uit ammoniak
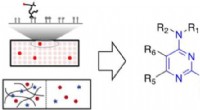
- Bepalen wat bindt aan slijm
 Onderwijs overtreft leeftijdsstructuur in termen van demografisch dividend
Onderwijs overtreft leeftijdsstructuur in termen van demografisch dividend Stollingsgesteente moet volgens de cyclus altijd sedimentair worden. Leg uit waarom deze bewering onjuist is?
Stollingsgesteente moet volgens de cyclus altijd sedimentair worden. Leg uit waarom deze bewering onjuist is?  Is elektriciteit zo snel licht?
Is elektriciteit zo snel licht?  NIST-team boekt vooruitgang bij het vertalen van de taal van nanoporiën
NIST-team boekt vooruitgang bij het vertalen van de taal van nanoporiën Hoe een infraroodspectrometer te gebruiken
Hoe een infraroodspectrometer te gebruiken  VLBA-meting belooft compleet beeld van Melkweg
VLBA-meting belooft compleet beeld van Melkweg Nachtverlichting verandert de manier waarop soorten met elkaar omgaan
Nachtverlichting verandert de manier waarop soorten met elkaar omgaan  Wat zijn de mogelijke eenheden voor arbeid en macht?
Wat zijn de mogelijke eenheden voor arbeid en macht?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

