
Wetenschap
Wat is kaliumjodide bromine reactie?
Hier is de evenwichtige chemische vergelijking voor de reactie:
2ki (aq) + br₂ (l) → 2kBr (aq) + i₂ (s)
Verklaring:
* kaliumjodide (ki) is een oplosbare ionische verbinding, wat betekent dat het bestaat als kalium (k⁺) en jodide (i⁻) ionen in oplossing.
* bromine (br₂) is een diatomee vloeibaar element.
* kaliumbromide (KBR) is ook een oplosbare ionische verbinding, die kalium (k⁺) en bromide (br⁻) ionen in oplossing vormt.
* jodium (i₂) is een solide element.
mechanisme:
De reactie treedt op omdat broom reactiever is dan jodium. Wanneer broom wordt toegevoegd aan een oplossing van kaliumjodide, verplaatsen broomatomen jodide -ionen uit de kaliumjodide -oplossing, die bromide -ionen en elementair jodium vormen.
Observaties:
* kleurverandering: De oplossing lijkt aanvankelijk kleurloos of licht geel. Naarmate de reactie verloopt, komt er een donkerbruine kleur naar voren vanwege de vorming van elementair jodium.
* vaste vorming: Als het reactiemengsel genoeg is geconcentreerd, zal vast jodium uit de oplossing neerslaan.
Belangrijke opmerking:
Deze reactie is een veel voorkomende demonstratie van de relatieve reactiviteit van halogenen. Bromine is reactiever dan jodium, en de reactie resulteert in de vorming van een minder reactief halogeen (jodium) en een zout (kaliumbromide).
 Een getal voor een chemische formule Een vergelijking die aangeeft hoeveel moleculen of atomen elk reactant en product betrekken zijn een reactie?
Een getal voor een chemische formule Een vergelijking die aangeeft hoeveel moleculen of atomen elk reactant en product betrekken zijn een reactie?  Hoe werkt een chemisch warmtepakket?
Hoe werkt een chemisch warmtepakket?  Waarom krijgen de atomen een grotere doorsnede als je naar groep 1 gaat?
Waarom krijgen de atomen een grotere doorsnede als je naar groep 1 gaat?  Efficiënter omgaan met grondstoffen met behulp van moleculaire transportbanden
Efficiënter omgaan met grondstoffen met behulp van moleculaire transportbanden Wat gebeurt er met Berkelium wanneer oververhit?
Wat gebeurt er met Berkelium wanneer oververhit?
 Welke factoren beïnvloeden de waarschijnlijkheid van fracking-gerelateerde seismiciteit in Oklahoma?
Welke factoren beïnvloeden de waarschijnlijkheid van fracking-gerelateerde seismiciteit in Oklahoma? Gezondheidswaarschuwingen terwijl West-Europa broeit onder hittegolf
Gezondheidswaarschuwingen terwijl West-Europa broeit onder hittegolf Menselijk dieet veroorzaakt catastrofale schade aan de planeet:studie
Menselijk dieet veroorzaakt catastrofale schade aan de planeet:studie Wat eet koraalriffen?
Wat eet koraalriffen?  De verrassende manier waarop kunststoffen daadwerkelijk kunnen helpen de klimaatverandering te bestrijden
De verrassende manier waarop kunststoffen daadwerkelijk kunnen helpen de klimaatverandering te bestrijden
Hoofdlijnen
- Oude microben bieden aanwijzingen voor hoe complex het leven is geëvolueerd
- Welke activiteit kan leiden tot schade van een microscoop en monster?
- Hoe genenbanken werken
- Wat is de studie van erfelijke kenmerken?
- Hoe een zieke cel te resetten
- De volgorde van de slakvissen uit de Mariana Trench onthult aanwijzingen over hoe deze zich aanpaste om in zulk diep water te leven
- Organellen die niet deelnemen aan eiwitsynthese?
- De aandelen van Apple verzuren, die van Microsoft stijgen. Zeg wat?!
- Welke drie omstandigheden zijn ideaal voor bacteriën om te groeien?
- Eenvoudig en high-throughput model voor het evalueren van de efficiëntie van fotodynamische agent
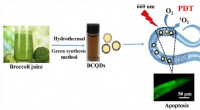
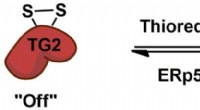
- Op zoek naar een uit-schakelaar voor coeliakie
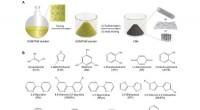
- Onderzoeksteam stelt een effectieve strategie voor om koolstofnanomaterialen voor te bereiden
- Onderzoekslaboratoriumsimulator voltooit essentieel onderzoek naar geneesmiddelen in dagen

- Een nieuwe kijk op kleurendisplays

 Fruitvliegtestikels bieden een potentieel hulpmiddel tegen schadelijke insecten
Fruitvliegtestikels bieden een potentieel hulpmiddel tegen schadelijke insecten  Vooruitgang en uitdagingen op weg naar het netto nulpunt:vragen en antwoorden
Vooruitgang en uitdagingen op weg naar het netto nulpunt:vragen en antwoorden  Welke faseveranderingen zijn exotherm en endotherm?
Welke faseveranderingen zijn exotherm en endotherm?  Wat zijn de oplossingen in het bos van het bos?
Wat zijn de oplossingen in het bos van het bos?  Tijdreizen zou mogelijk zijn, maar alleen met parallelle tijdlijnen
Tijdreizen zou mogelijk zijn, maar alleen met parallelle tijdlijnen Japan streeft naar kernenergie om energiecrisis te bestrijden
Japan streeft naar kernenergie om energiecrisis te bestrijden Hoe zou je de niche en habitat van een marmot kunnen beschrijven?
Hoe zou je de niche en habitat van een marmot kunnen beschrijven?  Het afkicken van de auto(bon)-gewoonte beter voor luchtvervuiling dan technologische revolutie
Het afkicken van de auto(bon)-gewoonte beter voor luchtvervuiling dan technologische revolutie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

