
Wetenschap
Wat is de moleculaire geometrie van koolstoftetra -bromide?
Koolstoftetrabromide (CBR4) heeft een tetrahedral moleculaire geometrie.
Dit is waarom:
* centraal atoom: Koolstof (C) is het centrale atoom.
* valentie -elektronen: Koolstof heeft 4 valentie -elektronen en elk broom (BR) atoom heeft 7 valentie -elektronen.
* binding: Koolstof vormt vier enkele covalente bindingen met vier broomatomen.
* elektronenparen: Er zijn vier bindingselektronenparen rond het centrale koolstofatoom.
* Vorm: De vier bindingsparen rangschikken zichzelf in een tetraëdrische vorm om afstoting te minimaliseren, wat resulteert in bindingshoeken van ongeveer 109,5 graden.
Daarom is de moleculaire geometrie van koolstoftetrabromide tetraëdrisch.
 Wat zijn natuurlijke hulpbronnen van CO2?
Wat zijn natuurlijke hulpbronnen van CO2?  Welk element wordt gevonden in alle organische verbindingen en levende orginismen?
Welk element wordt gevonden in alle organische verbindingen en levende orginismen?  Waar is sfeer van gemaakt?
Waar is sfeer van gemaakt?  Wat is het totale aantal natriumatomen in 46,0 gram?
Wat is het totale aantal natriumatomen in 46,0 gram?  Wat is de pH van een oplossing waarvan de hydroniumionconcentratie 5,03 is en nbsp acuut nbsp10-1 M?
Wat is de pH van een oplossing waarvan de hydroniumionconcentratie 5,03 is en nbsp acuut nbsp10-1 M?
 Ik hou van plastic:de giftige liefdesaffaire van Pakistan met afval
Ik hou van plastic:de giftige liefdesaffaire van Pakistan met afval Wat wordt er geselecteerd in natuurlijke selectie?
Wat wordt er geselecteerd in natuurlijke selectie?  Waarom is het geleidelijke verlies van regenwouden een belangrijke zorg voor het milieu?
Waarom is het geleidelijke verlies van regenwouden een belangrijke zorg voor het milieu?  Pine Island Glaciers-ijsplaat scheurt uit elkaar, de belangrijkste Antarctische gletsjer versnellen
Pine Island Glaciers-ijsplaat scheurt uit elkaar, de belangrijkste Antarctische gletsjer versnellen Amazonebranden zorgen ervoor dat de CO2-uitstoot van Brazilië stijgt tijdens een pandemie
Amazonebranden zorgen ervoor dat de CO2-uitstoot van Brazilië stijgt tijdens een pandemie
Hoofdlijnen
- Wanneer het equinox-gen verschijnt, herstelt de overgang naar hergroei
- Hoe DNA leidde tot de ongrijpbare 'Golden State Killer'
- Wat doet vijverkruid?
- Is de endodermis een huidlaag?
- Hoe beïnvloedt het type skelet de mobiliteit van een organisme?
- Neteldieren controleren bacteriën op afstand
- Wat zijn de functies-voordelen van een kaalblad?
- Welke soorten microscoop worden in een laboratorium gebruikt?
- Wat zijn organismen die voedsel beveiligen door andere te eten?
- Zo mooi als een pauw:de edelsteen voor de volgende generatie slimme sensoren

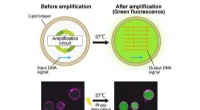
- Nieuwe DNA-amplificatiecapsule belooft veel voor de bestrijding van ziekten
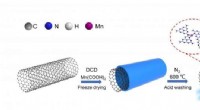
- Mangaan single-atom katalysator verhoogt de prestaties van elektrochemische kooldioxide-reductie
- Commercieel relevante op bismut gebaseerde dunnefilmverwerking

- Chemici creëren nieuwe diagnostische methode voor moeilijke klimatologische omstandigheden

 Wat is de naam van het sterrenbeeld waarnaar Noordpoolgebied is vernoemd?
Wat is de naam van het sterrenbeeld waarnaar Noordpoolgebied is vernoemd?  Wat is de Atmoshpere van Jupiter?
Wat is de Atmoshpere van Jupiter?  Hoe een verbod op positieve actie selectieve hogescholen en het personeelsbestand minder divers maakt
Hoe een verbod op positieve actie selectieve hogescholen en het personeelsbestand minder divers maakt Een nieuw model voor groepsbesluitvorming laat zien hoe 'volgers' de uitkomst kunnen beïnvloeden
Een nieuw model voor groepsbesluitvorming laat zien hoe 'volgers' de uitkomst kunnen beïnvloeden  Hoe teken je een heliumatoom?
Hoe teken je een heliumatoom?  Onderzoekers observeren nieuw type ijsvormen tussen lagen grafeenoxide
Onderzoekers observeren nieuw type ijsvormen tussen lagen grafeenoxide Slimme sensoren kunnen de manier waarop gebouwen worden ontworpen en bezet, veranderen
Slimme sensoren kunnen de manier waarop gebouwen worden ontworpen en bezet, veranderen Hoe een getal om te zetten in een percentage
Hoe een getal om te zetten in een percentage
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

