
Wetenschap
Is fluor vergelijkbare eigenschappen als chloor?
overeenkomsten:
* Elektronenconfiguratie: Beide hebben 7 valentie -elektronen, waardoor ze zeer reactief zijn en graag nog een elektron krijgen om een stabiel octet te bereiken.
* Reactiviteit: Beide zijn zeer reactieve niet -metalen, die gemakkelijk ionische bindingen vormen met metalen en covalente bindingen met andere niet -metalen.
* Oxidatietoestand: Beide vertonen gewoonlijk een -1 oxidatietoestand in verbindingen.
* Diatomaire moleculen vormen: Beide bestaan als diatomaire moleculen (F2 en CL2) in hun elementaire vorm.
* Halogeenseigenschappen: Ze delen algemene halogeenseigenschappen zoals sterke oxiderende middelen en goede desinfectiemiddelen zijn.
Verschillen:
* elektronegativiteit: Fluor is het meest elektronegatieve element, wat betekent dat het een sterkere aantrekkingskracht heeft op elektronen dan chloor.
* Reactiviteit: Fluor is nog reactiever dan chloor en reageert krachtig bij de meeste elementen, zelfs bij kamertemperatuur.
* bindingssterkte: Fluor vormt sterkere bindingen dan chloor vanwege zijn kleinere atoomgrootte en hogere elektronegativiteit.
* Fysieke toestand: Bij kamertemperatuur is fluor een gas, terwijl chloor een gas is maar gemakkelijk kan worden vloeibaar kan worden.
* kleur: Fluor is een lichtgeel gas, terwijl chloor een groenachtig geel gas is.
Samenvattend:
Fluor en chloor delen veel overeenkomsten vanwege hun halogene aard, maar fluor is reactiever en elektronegatief dan chloor, wat leidt tot enkele verschillende verschillen in hun chemische eigenschappen.
 Verschillen in de Veneuze Muur versus Arteriële wandcompositie
Verschillen in de Veneuze Muur versus Arteriële wandcompositie  Emissies van fossiele brandstoffen bereikten recordhoogte na onverwachte groei - Global Carbon Budget 2017
Emissies van fossiele brandstoffen bereikten recordhoogte na onverwachte groei - Global Carbon Budget 2017 Verschil tussen mieren en termieten
Verschil tussen mieren en termieten  Identificatie van gemeenschappen die risico lopen op de gevolgen van extreme hitte
Identificatie van gemeenschappen die risico lopen op de gevolgen van extreme hitte Landelijke gemeenschappen in Hawaï worden geconfronteerd met verschillende vulkaanbedreigingen
Landelijke gemeenschappen in Hawaï worden geconfronteerd met verschillende vulkaanbedreigingen
Hoofdlijnen
- Wat zijn verschillende soorten refferatie?
- Alleen structuren betrokken bij mitose van dierlijke cellen?
- Wat is de betekenis van mariene organismen?
- Hoe melkveehouders zich kunnen aanpassen aan klimaatverandering
- Hoe verschilt de vorm van epitheelcellen van wangcellen?
- Wie is de vader van de stralingsbiologie?
- Hoe wordt een transgene gemaakt?
- Wat is het proces waarin uw lichaam zichzelf reguleert?
- Waar in de cel vindt transcriptie en vertaling plaats?
- Wetenschappers ontwikkelen nieuwe elektrochemische/fluorescerende dual-mode biosensor
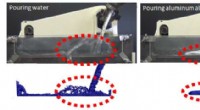
- Onderzoekers bootsen het gietgedrag van gesmolten metaal na met nieuw ontwikkelde simulatietechnologie
- Nieuwe methode om het comfort van slim en functioneel textiel te evalueren

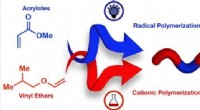
- Designer polymeren op aanvraag
- Kleine polymeerveren geven een boost aan het opruimen van het milieu
 Wat is het smelt- en kookpunt van grafiet?
Wat is het smelt- en kookpunt van grafiet?  Welke materialen worden gebruikt om een bekeranemometer te maken?
Welke materialen worden gebruikt om een bekeranemometer te maken?  Hoe zijn lava en magma hetzelfde?
Hoe zijn lava en magma hetzelfde?  Hoe een hoek te meten zonder een hoekmeter
Hoe een hoek te meten zonder een hoekmeter 180 g glucose en 342 sucrose hebben dezelfde aantal moleculen maar verschillende atomen. Uitleggen?
180 g glucose en 342 sucrose hebben dezelfde aantal moleculen maar verschillende atomen. Uitleggen?  Nieuwe manier om arrays van enkelwandige koolstofnanobuisjes te zuiveren, een stap in de richting van post-siliciumcircuits
Nieuwe manier om arrays van enkelwandige koolstofnanobuisjes te zuiveren, een stap in de richting van post-siliciumcircuits Wat gebeurt er nadat protonenpompen in mitochondriën tijdens de ATP -productie zijn uitgeputte elektronen van hun energie hebben uitgeput?
Wat gebeurt er nadat protonenpompen in mitochondriën tijdens de ATP -productie zijn uitgeputte elektronen van hun energie hebben uitgeput?  Nieuwe manier om rijst te koken verwijdert arseen en behoudt minerale voedingsstoffen, studie toont
Nieuwe manier om rijst te koken verwijdert arseen en behoudt minerale voedingsstoffen, studie toont
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

